
【题目】下图转化关系中的物质均为常见物质或它们的溶液,其中 A、C 为单质,B 为氧化物且常温下为无色液体,E 为淡黄色固体,H 为红褐色沉淀。(反应条件和部分产物已省略)
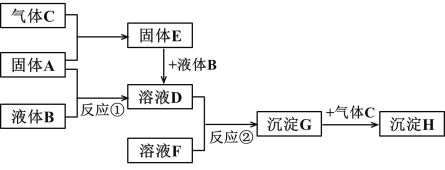
根据上述转化关系,回答问题:
(1)写出下列物质的化学式:A_________ G _________
(2)反应①的化学方程式为:______________________________________。反应②的离子方程式为:______________________________________。
(3)沉淀 G 转化为沉淀 H 的现象:________,化学方程式为___________
(4)写出物质 E 的一种用途________________________________。
(5)一定条件下,将一定量的 A 与足量的 C 充分反应,最终得到 39.0g 固体 E,则反应中转移的电子数为_______________。
【答案】Na Fe(OH)2 2Na+2H2O = 2NaOH + H2↑ Fe2++2OH- = Fe(OH)2↓ 白色沉淀迅速转化为灰绿色沉淀,最终转变为红褐色沉淀 4Fe(OH)2+2H2O+O2 = 4Fe(OH)3 潜水艇供氧剂或漂白剂 NA或6.02×1023
【解析】
B 为氧化物且常温下为无色液体,B 为H2O。E 为淡黄色固体,E 为Na2O2。根据物质的转化关系可知,A为Na,C 为O2,D为NaOH。H为红褐色沉淀,为Fe(OH)3,G 为Fe(OH)2,F为含有Fe2+的盐。
(1)由以上分析可知,A为Na, G 为Fe(OH)2。
(2)反应①的化学方程式为:2Na+2H2O = 2NaOH + H2↑;反应②的离子方程式为:Fe2++2OH- = Fe(OH)2↓。
(3)Fe(OH)2不稳定,易被氧化成Fe(OH)3,反应的现象为白色沉淀迅速转为灰绿色沉淀,最终变为红褐色沉淀。化学方程式为4Fe(OH)2+2H2O+O2 = 4Fe(OH)3。
(4)E 为Na2O2,可以和水、二氧化碳反应生成氧气,可用于潜水艇供氧剂或漂白剂。
(5)发生反应为2Na+ O2 ![]() Na2O2,最终得到 39.0g Na2O2,n(Na2O2)=
Na2O2,最终得到 39.0g Na2O2,n(Na2O2)=![]() =
=![]() =0.5mol,参与反应的 n(Na)= 0.5mol×2=1mol,反应中Na元素由0价升高到+1价,反应中转移的电子数为NA或6.02×1023。
=0.5mol,参与反应的 n(Na)= 0.5mol×2=1mol,反应中Na元素由0价升高到+1价,反应中转移的电子数为NA或6.02×1023。


科目:高中化学 来源: 题型:
【题目】水溶液中的行为是中学化学的重要内容,按要求回答下列问题.
(1)在醋酸水溶液中存在平衡CH3COOH![]() CH3COO-+H+若分别改变下列条件:①加水稀释②加热③加少量固体醋酸钠,其中能使醋酸电离程度增大的是_______,能使溶液pH增大的是_______(填序号)。
CH3COO-+H+若分别改变下列条件:①加水稀释②加热③加少量固体醋酸钠,其中能使醋酸电离程度增大的是_______,能使溶液pH增大的是_______(填序号)。
(2)常温下,0.1mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、CO32-、OH-四种微粒的浓度由大到小的顺序为:________________________________。
(3)AlCl3溶液加热蒸干并灼烧最终得到物质是________(填化学式),将NaHCO3与Al2(SO4)3溶液混合后可做泡沫灭火剂,其原理是_______(用离子方程式表示)。
(4)已知下列物质在20℃下的Ksp如下:
化学式 | AgCl | AgBr | AgI |
颜色 | 白色 | 浅黄色 | 黄色 |
Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 |
①当向含相同浓度Cl-、Br-、I-的溶液中滴加AgNO3溶液时,_______先沉淀(填离子符号),
②向BaCl2溶液中加入AgNO3和KBr,当两种淀共存时,  =__________。
=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 水的离子积常数KW只与温度有关,但若外加酸、碱会抑制水的电离,若外加盐则可能促进水的电离或不影响水的电离。
B. Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关。
C. 常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH![]() )/c(NH3·H2O)的值增大,故使NH3·H2O的Kb会减小。
)/c(NH3·H2O)的值增大,故使NH3·H2O的Kb会减小。
D. 室温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的pH= ,此酸的电离平衡常数K= ,由HA电离出的H+的浓度约为水电离出的H+的浓度的 倍。
(2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶剂。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①向该溶液中加入少量盐酸时,发生反应的离子方程式是 ,向其中加入少量KOH溶液时,发生反应的离子方程式是 。
②现将0.04mol﹒L-1HA溶液和0.02mol﹒L-1NaOH溶液等体积混合,得到缓冲溶液。
a、若HA为HCN,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”)。
b、若HA为CH3COOH,该溶液显酸性,溶液中所有的离子按浓度由大到小排列的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=1.该温度下在体积均为1L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5min时的浓度如表所示.下列判断不正确的是( )
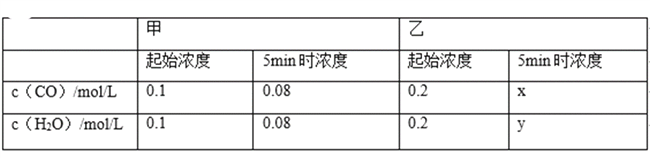
A. x=y=0.16
B. 反应开始时,乙中反应速率比甲快
C. 甲中0~5min的平均反应速率:v(CO)=0.004 mol/(Lmin)
D. 平衡时,乙中H2O的转化率是50%,c(CO)是甲中的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol .L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
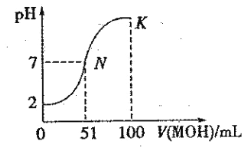
(1)由图中信息可知HA为 酸(填“强”或“弱”),理由是 _。
(2)常温下一定浓度的MA稀溶液的pH = a,则a 7(填“ > ”、“,< ”或“=”),用离子方程式表示其原因: ____________,此时,溶液中由水电离出的c(OH-)= 。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_________。
(4)K 点对应的溶液中,c(M+) +c(MOH) 2c (A-)(填“>”“<”或“=”);若此时溶液的 pH = 10,则 c(MOH) +c(OH-) = mol· L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘油具有吸水保湿性能。工业上由丙烯制备甘油的流程之一如下:
![]()
下列说法中正确的是
A. ①②③均为取代反应
B. CH2ClCHClCH2Cl的同分异构体有5种(不含立体异构)
C. 流程中4种有机物均可使溴的CCl4溶液褪色
D. CH2=CHCH2Cl、CH3CH=CH2分子均至少有6个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 工业上电解熔融的Al2O3冶炼铝用铁做阳极
B. 用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1molNaOH
C. 用Pt做电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1∶2
D. 用碳棒做电极电解CuSO4溶液一段时间后,加入Cu(OH)2固体可以使CuSO4溶液恢复原来浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com