
【题目】水溶液中的行为是中学化学的重要内容,按要求回答下列问题.
(1)在醋酸水溶液中存在平衡CH3COOH![]() CH3COO-+H+若分别改变下列条件:①加水稀释②加热③加少量固体醋酸钠,其中能使醋酸电离程度增大的是_______,能使溶液pH增大的是_______(填序号)。
CH3COO-+H+若分别改变下列条件:①加水稀释②加热③加少量固体醋酸钠,其中能使醋酸电离程度增大的是_______,能使溶液pH增大的是_______(填序号)。
(2)常温下,0.1mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、CO32-、OH-四种微粒的浓度由大到小的顺序为:________________________________。
(3)AlCl3溶液加热蒸干并灼烧最终得到物质是________(填化学式),将NaHCO3与Al2(SO4)3溶液混合后可做泡沫灭火剂,其原理是_______(用离子方程式表示)。
(4)已知下列物质在20℃下的Ksp如下:
化学式 | AgCl | AgBr | AgI |
颜色 | 白色 | 浅黄色 | 黄色 |
Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 |
①当向含相同浓度Cl-、Br-、I-的溶液中滴加AgNO3溶液时,_______先沉淀(填离子符号),
②向BaCl2溶液中加入AgNO3和KBr,当两种淀共存时,  =__________。
=__________。
【答案】 ①② ①③ c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) Al2O3 3HCO3-+Al3+=Al(OH)3↓+3CO2↑ I- 2.7×10-3
【解析】(1)醋酸存在电离平衡CH3COOH![]() H++CH3COO-,电离故事吸热过程,加热、加水稀释、加入碱性物质均能使电离平衡向右移动,能使醋酸电离程度增大的是:①加水稀释;②加热;答案选①②;①加水稀释氢离子浓度减小,溶液pH增大;②加热促进电离氢离子浓度增大,pH减小;③加少量固体醋酸钠,醋酸根离子浓度增大,抑制醋酸电离,氢离子浓度减小,pH增大;能使溶液pH增大的是①③;(2)常温下,0.1mol·L-1NaHCO3溶液的pH大于8,c(OH-)>c(H+),说明HCO3-水解程度大于其电离程度,故c(Na+)>c(HCO3-)、c(H2CO3)>c(CO32-),水解程度不大所以c(HCO3-)>c(H2CO3)、c(HCO3-)>c(OH-),溶液中氢氧根来源于水的电离与HCO3-水解,故c(OH-)>c(H2CO3),所以c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-);(3)AlCl3溶液在加热时水解生成Al(OH)3,生成的HCl易挥发,最终生成Al(OH)3,在加强热时,Al(OH)3不稳定,分解生成Al2O3;Al2(SO4)3溶液中,硫酸铝水解生成氢氧化铝和硫酸,Al2(SO4)3+6H2O
H++CH3COO-,电离故事吸热过程,加热、加水稀释、加入碱性物质均能使电离平衡向右移动,能使醋酸电离程度增大的是:①加水稀释;②加热;答案选①②;①加水稀释氢离子浓度减小,溶液pH增大;②加热促进电离氢离子浓度增大,pH减小;③加少量固体醋酸钠,醋酸根离子浓度增大,抑制醋酸电离,氢离子浓度减小,pH增大;能使溶液pH增大的是①③;(2)常温下,0.1mol·L-1NaHCO3溶液的pH大于8,c(OH-)>c(H+),说明HCO3-水解程度大于其电离程度,故c(Na+)>c(HCO3-)、c(H2CO3)>c(CO32-),水解程度不大所以c(HCO3-)>c(H2CO3)、c(HCO3-)>c(OH-),溶液中氢氧根来源于水的电离与HCO3-水解,故c(OH-)>c(H2CO3),所以c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-);(3)AlCl3溶液在加热时水解生成Al(OH)3,生成的HCl易挥发,最终生成Al(OH)3,在加强热时,Al(OH)3不稳定,分解生成Al2O3;Al2(SO4)3溶液中,硫酸铝水解生成氢氧化铝和硫酸,Al2(SO4)3+6H2O![]() 2Al(OH)3+3H2SO4,硫酸是难挥发性的酸,加热蒸干并灼烧最终得到物质是Al2(SO4)3,将NaHCO3与Al2(SO4)3两者溶液混合后可做泡沫灭火剂是利用二者发生双水解生成氢氧化铝沉淀和二氧化碳,反应的离子方程式为:3HCO3-+Al3+=Al (OH)3 ↓+3CO2↑;(4)①向含相同 浓度Cl-、Br-、I-的溶液中滴加AgNO3溶液时AgCl、AgBr、AgI三者的浓度积Qc相等,因为Ksp(AgI)最小,所以首先Qc>Ksp的为AgI其次为AgBr最后为AgCl,故先沉淀的离子为I-;②向BaCl2 溶液中加入AgNO3和KBr,当两种沉淀共存时,
2Al(OH)3+3H2SO4,硫酸是难挥发性的酸,加热蒸干并灼烧最终得到物质是Al2(SO4)3,将NaHCO3与Al2(SO4)3两者溶液混合后可做泡沫灭火剂是利用二者发生双水解生成氢氧化铝沉淀和二氧化碳,反应的离子方程式为:3HCO3-+Al3+=Al (OH)3 ↓+3CO2↑;(4)①向含相同 浓度Cl-、Br-、I-的溶液中滴加AgNO3溶液时AgCl、AgBr、AgI三者的浓度积Qc相等,因为Ksp(AgI)最小,所以首先Qc>Ksp的为AgI其次为AgBr最后为AgCl,故先沉淀的离子为I-;②向BaCl2 溶液中加入AgNO3和KBr,当两种沉淀共存时, 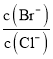 =
=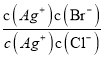 =
=![]() =
=![]() =2.7×10-3。
=2.7×10-3。


科目:高中化学 来源: 题型:
【题目】等体积的Na2SO4、KAl(SO4)2、Al2(SO4)3三种溶液分别与等体积、等浓度的BaCl2溶液恰好完全反应,则三溶液的物质的量浓度之比为()
A. 1:2:3 B. 6:3:2 C. 2:3:6 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仔细观察下图,下列叙述错误的是
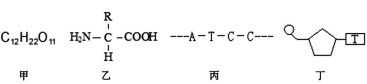
A. 在人体细胞内检测到图甲的化合物可能是乳糖
B. 组成人体的化合物乙的R基种类约有20种
C. 图丙中共有4种含氮碱基,4种脱氧核苷酸
D. 组成图丁中化合物的单糖一定是脱氧核糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型Zn-GO(GO为氧化石墨烯:C2O)电池,如图所示,GO反应过程中转化为rGO(rGO为石墨烯:C)。下列有关说法错误的是
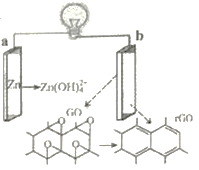
A. 电池工作时,电子由a经外电路流向b
B. b极电极反应式:C2O+2e-+H2O=2C+2OH-
C. 每生成0.1molZn(OH)42-,转移电子数为0.2NA
D. 放电过程中电解质溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.1mol/L的NaClO溶液中滴加稀硫酸,HClO和ClO-所占分数(α)随pH变化的关系如图所示。下列表述不正确的是
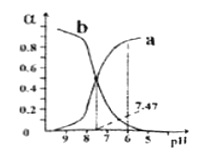
A. 曲线b代表ClO-
B. HClO的电离平衡常数Ka=10-7.47
C. pH=7时,c(Na+)>c(HClO)>c(ClO-)
D. 向pH=6的该溶液中加入少量的Na2SO3固体,c(ClO-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、CO32-、SO42-中的不同阳、阴离子各一种组成已知:
①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;
②0.1mol/L乙溶液中c(H+)>0.1mol/L;
③向丙容器中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。
(1)甲是_____________,乙是_____________,丙是_____________,丁是_____________。
(2)50mL含Na2SO4、Na2CO3的混合溶液中加入过量的甲溶液,得到14.51g白色沉淀,向白色沉淀中加入过量的稀HNO3充分反应后,沉淀减少到4.66g,并有气体产生。
①写出产生气体的离子方程式:______________________________;
②混合溶液中Na+的物质的量的浓度是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图中四个图像的说法正确的是
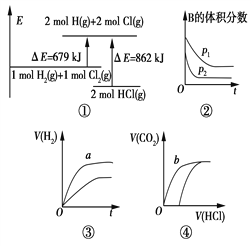
注:图中,E表示能量,p表示压强,t表示时间,y表示体积。
A. ①表示化学反应H2(g)+Cl2(g)===2HCl(g)的能量变化,则该反应的反应热ΔH=183 kJ/mol
B. ②表示其他条件不变时,反应4A(g)+3B(g) ![]() 2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是非气体。
2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是非气体。
C. ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示HCl溶液。
D. ④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图转化关系中的物质均为常见物质或它们的溶液,其中 A、C 为单质,B 为氧化物且常温下为无色液体,E 为淡黄色固体,H 为红褐色沉淀。(反应条件和部分产物已省略)
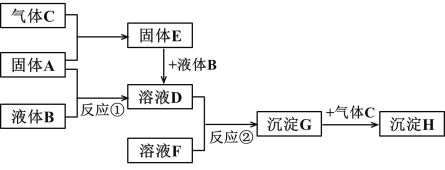
根据上述转化关系,回答问题:
(1)写出下列物质的化学式:A_________ G _________
(2)反应①的化学方程式为:______________________________________。反应②的离子方程式为:______________________________________。
(3)沉淀 G 转化为沉淀 H 的现象:________,化学方程式为___________
(4)写出物质 E 的一种用途________________________________。
(5)一定条件下,将一定量的 A 与足量的 C 充分反应,最终得到 39.0g 固体 E,则反应中转移的电子数为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com