
【题目】向0.1mol/L的NaClO溶液中滴加稀硫酸,HClO和ClO-所占分数(α)随pH变化的关系如图所示。下列表述不正确的是
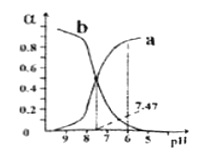
A. 曲线b代表ClO-
B. HClO的电离平衡常数Ka=10-7.47
C. pH=7时,c(Na+)>c(HClO)>c(ClO-)
D. 向pH=6的该溶液中加入少量的Na2SO3固体,c(ClO-)增大
【答案】D
【解析】A、NaClO中滴加H2SO4,发生2NaClO+H2SO4=Na2SO4+2HClO,ClO-所占分数逐渐降低,HClO所占分数逐渐增大,因此曲线b代表ClO-,故A说法正确;B、电离平衡常数只受温度的影响,当pH=7.47时c(ClO-)=c(HClO),根据电离平衡常数的定义,即HClO的电离平衡常数K=![]() ,故B说法正确;C、根据电荷守恒,c(Na+)+c(H+)=c(ClO-)+c(OH-)+2c(SO42-),当pH=7时,c(Na+)=c(ClO-)+2c(SO42-),推出c(Na+)>c(ClO-),根据图像,当pH=7时c(HClO)>c(ClO-),根据物料守恒,c(Na+)=c(ClO-)+c(HClO),推出c(Na+)>c(HClO),因此有c(Na+)>c(HClO)>c(ClO-),故C说法正确;D、NaClO具有强氧化性,Na2SO3中S显+4价,具有还原性,发生ClO-+SO32-=Cl-+SO42-,c(ClO-)减小,故D说法错误。
,故B说法正确;C、根据电荷守恒,c(Na+)+c(H+)=c(ClO-)+c(OH-)+2c(SO42-),当pH=7时,c(Na+)=c(ClO-)+2c(SO42-),推出c(Na+)>c(ClO-),根据图像,当pH=7时c(HClO)>c(ClO-),根据物料守恒,c(Na+)=c(ClO-)+c(HClO),推出c(Na+)>c(HClO),因此有c(Na+)>c(HClO)>c(ClO-),故C说法正确;D、NaClO具有强氧化性,Na2SO3中S显+4价,具有还原性,发生ClO-+SO32-=Cl-+SO42-,c(ClO-)减小,故D说法错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是()
A. 在25℃ 101KPa时,11.2 L氢气含有0.5 NA个氢分子
B. 标准状况下,20 L的N2和2.4 L的O2所含分子总数约为NA
C. 在标准状况下,18 g 水含有电子数为8 NA
D. 在25℃ 101KPa时,1 mol 氦气含有2 NA 个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小麦种子萌发时产生淀粉酶,将淀粉水解为麦芽糖、葡萄糖等。小麦种子萌发的最适温度为30℃左右。取适量小麦种子在20℃和30℃培养箱中培养4天后,做如下处理:在3支试管中加入等量斐林试剂并加热至50℃左右,摇匀后观察试管中的颜色。结果是( )

A.甲呈蓝色,乙呈砖红色,丙呈无色
B.甲呈无色,乙呈砖红色,丙呈蓝色
C.甲、乙皆呈蓝色,丙呈砖红色
D.甲呈浅砖红色,乙呈砖红色,丙呈蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是( )
A. 由水电离出的c(H+)=10-2mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存
B. 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
C. 某温度时的混合溶液中c(H+)=![]() mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
D. 己知Ksp(AgCl)=1.56×10-10,Ksp=(Ag2CrO4)=9.0×10-12。向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,SO2表现氧化性的是( )
A.SO2与水反应
B.SO2与H2S溶液反应
C.SO2与NaOH溶液反应
D.SO2与酸性高锰酸钾溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中的行为是中学化学的重要内容,按要求回答下列问题.
(1)在醋酸水溶液中存在平衡CH3COOH![]() CH3COO-+H+若分别改变下列条件:①加水稀释②加热③加少量固体醋酸钠,其中能使醋酸电离程度增大的是_______,能使溶液pH增大的是_______(填序号)。
CH3COO-+H+若分别改变下列条件:①加水稀释②加热③加少量固体醋酸钠,其中能使醋酸电离程度增大的是_______,能使溶液pH增大的是_______(填序号)。
(2)常温下,0.1mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、CO32-、OH-四种微粒的浓度由大到小的顺序为:________________________________。
(3)AlCl3溶液加热蒸干并灼烧最终得到物质是________(填化学式),将NaHCO3与Al2(SO4)3溶液混合后可做泡沫灭火剂,其原理是_______(用离子方程式表示)。
(4)已知下列物质在20℃下的Ksp如下:
化学式 | AgCl | AgBr | AgI |
颜色 | 白色 | 浅黄色 | 黄色 |
Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 |
①当向含相同浓度Cl-、Br-、I-的溶液中滴加AgNO3溶液时,_______先沉淀(填离子符号),
②向BaCl2溶液中加入AgNO3和KBr,当两种淀共存时,  =__________。
=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氮化硫(SN)x和K3C60是两种不同类型的超导材料。回答下列问题:
(1)在基态K原子中,能量最低的空轨道的符号是_____________。
(2)S、N、K三种元素的第一电离能由大到小的顺序是____________。
(3)(SN)x具有类似黄铜的金属光泽和导电性,其结构如下图:
![]()
以S2Cl2为原料可制取(SN)x:S2Cl2→…S4N4 ![]() S2N2
S2N2 ![]() (SN)x
(SN)x
①(SN)x中N原子的杂化方式是_________;(SN)x的晶体类型是______;
②S2Cl2的结构式为________;
③Ag元素位于周期表第5周期、IB族,基态Ag原子的价电子排布式为__________。
(4)K3C60是由足球烯(C60)与金属钾反应生成的盐。
①在K3C60晶胞中,C603-堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,K+填充在空隙中。晶胞中被K+占据的空隙百分比为___________。
②C60与金刚石互为同素异形休,比较两者的熔沸点并说明理由____________。
③C60的结构是一种多面体,如图。多面体的顶点数、面数和棱边数的关系遵循欧拉定律:顶点数+面数-棱边数=2。C60分子中所含的五边形和六边形的个数分别为_____、______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2通入下列溶液中,溶液褪色或变浅,说明SO2具有漂白作用的组合是( )
①KMnO4(H+ , aq) ②溴水 ③碘水 ④氯水 ⑤Fe3+(aq)
A.①⑤
B.②③
C.全部
D.都不是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=1.该温度下在体积均为1L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5min时的浓度如表所示.下列判断不正确的是( )
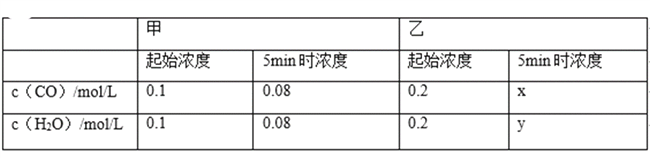
A. x=y=0.16
B. 反应开始时,乙中反应速率比甲快
C. 甲中0~5min的平均反应速率:v(CO)=0.004 mol/(Lmin)
D. 平衡时,乙中H2O的转化率是50%,c(CO)是甲中的2倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com