
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是()
A. 在25℃ 101KPa时,11.2 L氢气含有0.5 NA个氢分子
B. 标准状况下,20 L的N2和2.4 L的O2所含分子总数约为NA
C. 在标准状况下,18 g 水含有电子数为8 NA
D. 在25℃ 101KPa时,1 mol 氦气含有2 NA 个原子
【答案】B
【解析】
在0℃ 101KPa时,11.2 L氢气的物质的量是0.5mol;标准状况下,1mol任何气体的体积都约是22.4L;18 g的物质的量是![]() ;氦气是单原子分子,1个氦气分子中含有1个氦原子。
;氦气是单原子分子,1个氦气分子中含有1个氦原子。
在0℃ 101KPa时,11.2 L氢气的物质的量是0.5mol,故A错误;标准状况下,1mol任何气体的体积都约是22.4L,所以标准状况下20 L的N2和2.4 L的O2的总物质的量是1mol,含分子总数约为NA,故B正确;1个水分子含有10个电子,18 g的物质的量是![]() ,所以18 g 水含有电子数为10 NA,故C错误;氦气是单原子分子,1 mol 氦气含有NA 个原子,故D错误。
,所以18 g 水含有电子数为10 NA,故C错误;氦气是单原子分子,1 mol 氦气含有NA 个原子,故D错误。


科目:高中化学 来源: 题型:
【题目】某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是_______,说明氧化性Ag+>Cu2+。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
实验 | 试剂 | 编号及现象 | |
试管 | 滴管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
① 经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
② 经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:
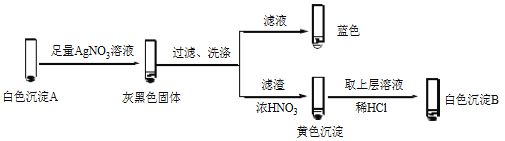
a.检验滤液无I2。溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是____,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
编号 | 实验1 | 实验2 | 实验3 |
实验 |
|
|
|
现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极 上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黄色的原因是_______(用电极反应式表示)。
② “实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_______。
③ 方案2中,Cu2+能氧化I-,而Ag+未能氧化I-的原因:_______。
(资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往FeCl3和BaCl2的混合溶液中通入SO2 , 溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。下列说法正确的是( )
A.该实验表明FeCl3有还原性
B.白色沉淀为BaSO3
C.该实验表明SO2有漂白性
D.反应后溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B两个装置中的烧杯分别盛有足量的CuCl2溶液。

(1)A、B、C三个装置中属于原电池的是________(填标号,下同),属于电解池的是_____________
(2)A池中Zn是_____极,电极反应式为________;Cu是______极,电极反应式为______________,A中总反应的方程式为________________________。
(3)B池中总反应的方程式为________________。
(4)C池中Zn是____极,电极反应式为_____;Cu是______极,电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的Na2SO4、KAl(SO4)2、Al2(SO4)3三种溶液分别与等体积、等浓度的BaCl2溶液恰好完全反应,则三溶液的物质的量浓度之比为()
A. 1:2:3 B. 6:3:2 C. 2:3:6 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组需配制含有NH![]() 、Cl-、K+、SO42-的植物培养液500 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④胶头滴管 ⑤量筒。请回答下列问题:
、Cl-、K+、SO42-的植物培养液500 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④胶头滴管 ⑤量筒。请回答下列问题:
(1)该植物培养液中,NH![]() 的物质的量浓度为__________mol·L-1;
的物质的量浓度为__________mol·L-1;
(2)该研究小组配制该植物培养液时,还须用到的玻璃实验仪器有__________、__________;
(3)甲同学用NH4Cl、(NH4)2SO4和K2SO4三种物质进行配制,则需硫酸铵的质量为__________g;
(4)若配制该培养液的其他操作均正确,则下列错误操作将使所配制溶液的浓度偏低的是__________。
a.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
b.将烧杯内的溶液向容量瓶中转移时,容量瓶中还有少量的水
c.将烧杯内的溶液向容量瓶中转移时,因操作不当使部分溶液溅出容量瓶
d.用胶头滴管向容量瓶中加水时,俯视容量瓶刻度线
e.摇匀后发现液面低于容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是

A. 该电池不适宜在过高或过低温度下使用
B. 正极反应中有CO2生成
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2==6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.1mol/L的NaClO溶液中滴加稀硫酸,HClO和ClO-所占分数(α)随pH变化的关系如图所示。下列表述不正确的是
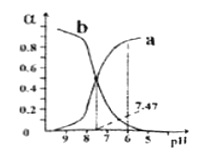
A. 曲线b代表ClO-
B. HClO的电离平衡常数Ka=10-7.47
C. pH=7时,c(Na+)>c(HClO)>c(ClO-)
D. 向pH=6的该溶液中加入少量的Na2SO3固体,c(ClO-)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com