
【题目】往FeCl3和BaCl2的混合溶液中通入SO2 , 溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。下列说法正确的是( )
A.该实验表明FeCl3有还原性
B.白色沉淀为BaSO3
C.该实验表明SO2有漂白性
D.反应后溶液酸性增强
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)
A. 11.52 B. 11.70
C. 11.82 D. 12.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组为测定钠元素的相对原子质量,设计的装置如图所示,该装置(包括水和干燥剂)的总质量为ag,从实验室取出bg(不足量)钠放入水中,塞紧瓶塞,完全反应后再称量此装置的总质量为cg。试回答:

(1)实验室取用一小块钠,需要用到__________________实验仪器。
(2)此干燥管的作用是________________________;若此钠块有极少量被氧化,则测出的相对原子质量会比实际相对原子质量________(填“偏大”、“偏小”或“不变”)。
(3)有甲同学建议在图中干燥管上再连一同样干燥管,其目的是____________________,计算钠的相对原子质量的表达式为____________________。
(4)有乙同学为避免由于行动不够迅速产生偏差,又建议在集气瓶中再加入一定量煤油,其目的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.由于地壳的岩层里含硫及其化合物,因此火山喷出物中含有H2S、SO2等硫的化合物
B.化石燃料直接燃烧会产生对大气有严重污染的SO2气体
C.硫在空气中燃烧的产物是SO2 , 在氧气中燃烧的产物是SO3
D.硫是一种淡黄色晶体,不溶于水,微溶于酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓是一种低熔点高沸点的稀有金属,有“电子工业脊梁”的美誉,被广泛应用到光电子工业和微波通信工业;镓(Ga)与铝位于同一主族,金属镓的熔点是29.8℃,沸点是2403℃。
(1)工业上利用Ga(l)与NH3(g)在1000℃高温下合成半导体固体材料氮化镓(GaN),同时生成氢气,每生成lmol H2时放出10.3 kJ热量。写出该反应的热化学方程式__________________。
(2)在密闭容器中,充入一定量的Ga与NH3发生反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。
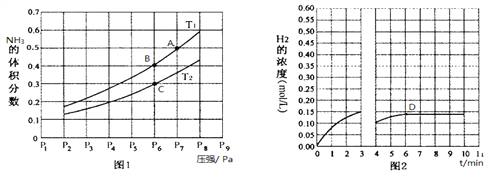
① 图1中A点和C点化学平衡常数的大小关系是:KA_____KC,(填“<”、“=”或“>”),理由是__________________________________________________。
② 该反应在T1和P6条件下至3min时达到平衡,此时改变条件并于D点处重新达到平衡,H2的浓度随反应时间的变化趋势如图2所示(3~4 min的浓度变化未表示出来),则改变的条件为__________(仅改变温度或压强中的一种)。
(3)若用压强平衡常数Kp表示,此时B点对应的Kp=__________(用含P6的式子表示)(Kp为压强平衡常数,用平衡分压代替平衡浓度计算,气体平衡分压=总压×气体体积分数)
(4)电解精炼法提纯镓的具体原理如下:以粗镓(含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH溶液为电解质。在电流作用下使粗镓溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+。电解精炼镓时阳极泥的成分是_________。
②阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,写出GaO2-在阴极放电的电极反应式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对SO2和SO3的叙述正确的是( )
A.通常条件下,都是无色气体,都易溶于水
B.都是酸性氧化物,其水溶液都是强酸
C.都可使品红溶液褪色,加热时红色又能再现
D.都能跟碱溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是()
A. 在25℃ 101KPa时,11.2 L氢气含有0.5 NA个氢分子
B. 标准状况下,20 L的N2和2.4 L的O2所含分子总数约为NA
C. 在标准状况下,18 g 水含有电子数为8 NA
D. 在25℃ 101KPa时,1 mol 氦气含有2 NA 个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
A. v(A)=0.15mol/(Lmin)
B. v(B)=0.04mol/(Ls)
C. v(C)=0.03mol/(Ls)
D. v(D)=0.4mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是( )
A. 由水电离出的c(H+)=10-2mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存
B. 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
C. 某温度时的混合溶液中c(H+)=![]() mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
D. 己知Ksp(AgCl)=1.56×10-10,Ksp=(Ag2CrO4)=9.0×10-12。向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com