
【题目】下列有关说法中正确的是( )
A. 由水电离出的c(H+)=10-2mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存
B. 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
C. 某温度时的混合溶液中c(H+)=![]() mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
D. 己知Ksp(AgCl)=1.56×10-10,Ksp=(Ag2CrO4)=9.0×10-12。向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
【答案】C
【解析】A、常温下由水电离出的c(H+)=10-12 mol·L-1 的溶液可能呈酸性,也可能呈碱性,其pH可能为2或12,HCO3-都不能大量存在,选项A错误;B、常温下pH=7的CH3COOH和NaOH混合溶液中c(H+)=c(OH-),根据电荷守恒有c(Na+)=c(CH3COO-),选项B错误;C、某温度时的混合溶液中c(H+)=![]() mol·L-1,则c(OH-)=
mol·L-1,则c(OH-)=![]() mol·L-1=c(H+)=
mol·L-1=c(H+)=![]() mol·L-1,溶液呈中性,选项C正确;D、析出沉淀时,AgCl溶液中c(Ag+)=
mol·L-1,溶液呈中性,选项C正确;D、析出沉淀时,AgCl溶液中c(Ag+)=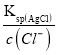 =
=![]() mol/L=1.56×10-8mol/L,Ag2CrO4溶液中c(Ag+)=
mol/L=1.56×10-8mol/L,Ag2CrO4溶液中c(Ag+)=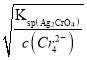 =
=![]() mol/L =3×10-5,c(Ag+)越小,则越先生成沉淀,所以种阴离子产生沉淀的先后顺序为Cl-、CrO42-,即Cl-先产生沉淀,选项D错误。答案选C。
mol/L =3×10-5,c(Ag+)越小,则越先生成沉淀,所以种阴离子产生沉淀的先后顺序为Cl-、CrO42-,即Cl-先产生沉淀,选项D错误。答案选C。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】往FeCl3和BaCl2的混合溶液中通入SO2 , 溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。下列说法正确的是( )
A.该实验表明FeCl3有还原性
B.白色沉淀为BaSO3
C.该实验表明SO2有漂白性
D.反应后溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是

A. 该电池不适宜在过高或过低温度下使用
B. 正极反应中有CO2生成
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2==6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仔细观察下图,下列叙述错误的是
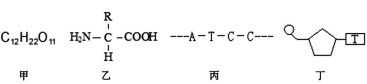
A. 在人体细胞内检测到图甲的化合物可能是乳糖
B. 组成人体的化合物乙的R基种类约有20种
C. 图丙中共有4种含氮碱基,4种脱氧核苷酸
D. 组成图丁中化合物的单糖一定是脱氧核糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯(CH3CH=CH2)与溴水反应时,对反应产物的推测正确的是
A.CH2BrCH2CH2BrB.CH3CHBr2CH3
C.CH3CH2CHBrD.CH3CHBrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型Zn-GO(GO为氧化石墨烯:C2O)电池,如图所示,GO反应过程中转化为rGO(rGO为石墨烯:C)。下列有关说法错误的是
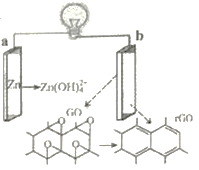
A. 电池工作时,电子由a经外电路流向b
B. b极电极反应式:C2O+2e-+H2O=2C+2OH-
C. 每生成0.1molZn(OH)42-,转移电子数为0.2NA
D. 放电过程中电解质溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.1mol/L的NaClO溶液中滴加稀硫酸,HClO和ClO-所占分数(α)随pH变化的关系如图所示。下列表述不正确的是
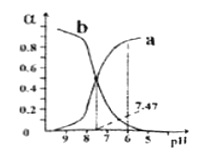
A. 曲线b代表ClO-
B. HClO的电离平衡常数Ka=10-7.47
C. pH=7时,c(Na+)>c(HClO)>c(ClO-)
D. 向pH=6的该溶液中加入少量的Na2SO3固体,c(ClO-)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com