
【题目】由乙烯推测丙烯(CH3CH=CH2)与溴水反应时,对反应产物的推测正确的是
A.CH2BrCH2CH2BrB.CH3CHBr2CH3
C.CH3CH2CHBrD.CH3CHBrCH2Br
科目:高中化学 来源: 题型:
【题目】镓是一种低熔点高沸点的稀有金属,有“电子工业脊梁”的美誉,被广泛应用到光电子工业和微波通信工业;镓(Ga)与铝位于同一主族,金属镓的熔点是29.8℃,沸点是2403℃。
(1)工业上利用Ga(l)与NH3(g)在1000℃高温下合成半导体固体材料氮化镓(GaN),同时生成氢气,每生成lmol H2时放出10.3 kJ热量。写出该反应的热化学方程式__________________。
(2)在密闭容器中,充入一定量的Ga与NH3发生反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。
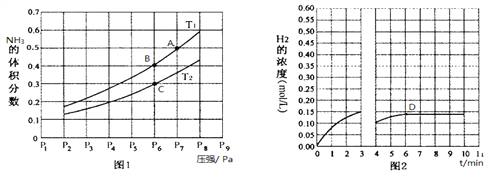
① 图1中A点和C点化学平衡常数的大小关系是:KA_____KC,(填“<”、“=”或“>”),理由是__________________________________________________。
② 该反应在T1和P6条件下至3min时达到平衡,此时改变条件并于D点处重新达到平衡,H2的浓度随反应时间的变化趋势如图2所示(3~4 min的浓度变化未表示出来),则改变的条件为__________(仅改变温度或压强中的一种)。
(3)若用压强平衡常数Kp表示,此时B点对应的Kp=__________(用含P6的式子表示)(Kp为压强平衡常数,用平衡分压代替平衡浓度计算,气体平衡分压=总压×气体体积分数)
(4)电解精炼法提纯镓的具体原理如下:以粗镓(含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH溶液为电解质。在电流作用下使粗镓溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+。电解精炼镓时阳极泥的成分是_________。
②阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,写出GaO2-在阴极放电的电极反应式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是
A. H2、I2(g)、HI平衡混合气体加压后颜色变深(已知:H2 +I2(g)![]() 2HI)
2HI)
B. 合成氨时,将混合气体中的NH3液化有利于提高产率
C. 实验室用排饱和食盐水的方法收集氯气
D. 滴加酚酞的氨水中加入氯化铵固体后红色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小麦种子萌发时产生淀粉酶,将淀粉水解为麦芽糖、葡萄糖等。小麦种子萌发的最适温度为30℃左右。取适量小麦种子在20℃和30℃培养箱中培养4天后,做如下处理:在3支试管中加入等量斐林试剂并加热至50℃左右,摇匀后观察试管中的颜色。结果是( )

A.甲呈蓝色,乙呈砖红色,丙呈无色
B.甲呈无色,乙呈砖红色,丙呈蓝色
C.甲、乙皆呈蓝色,丙呈砖红色
D.甲呈浅砖红色,乙呈砖红色,丙呈蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究者设计利用芳香族化合物的特殊性质合成某药物,其合成路线如下(部分反应试剂和条件已省略):

已知:Ⅰ. 
Ⅱ. 
回答下列问题:
(1)B的名称是____________________。
(2)反应②和⑤所属的反应类型分别为____________、_____________。
(3)反应④所需的条件为___________,E分子中官能团的名称为_________________。
(4)反应⑥的化学方程式为________________________________。
(5)芳香族化合物X是C的同分异构体,X只含一种官能团且1mol X与足量NaHCO3溶液发生反应生成2 molCO2,则X的结构有__________种。其中核磁共振氢谱显示有4组峰,且峰面积之比为3 :2 : 2 :1的结构简式为____________、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是( )
A. 由水电离出的c(H+)=10-2mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存
B. 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
C. 某温度时的混合溶液中c(H+)=![]() mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
D. 己知Ksp(AgCl)=1.56×10-10,Ksp=(Ag2CrO4)=9.0×10-12。向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,SO2表现氧化性的是( )
A.SO2与水反应
B.SO2与H2S溶液反应
C.SO2与NaOH溶液反应
D.SO2与酸性高锰酸钾溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氮化硫(SN)x和K3C60是两种不同类型的超导材料。回答下列问题:
(1)在基态K原子中,能量最低的空轨道的符号是_____________。
(2)S、N、K三种元素的第一电离能由大到小的顺序是____________。
(3)(SN)x具有类似黄铜的金属光泽和导电性,其结构如下图:
![]()
以S2Cl2为原料可制取(SN)x:S2Cl2→…S4N4 ![]() S2N2
S2N2 ![]() (SN)x
(SN)x
①(SN)x中N原子的杂化方式是_________;(SN)x的晶体类型是______;
②S2Cl2的结构式为________;
③Ag元素位于周期表第5周期、IB族,基态Ag原子的价电子排布式为__________。
(4)K3C60是由足球烯(C60)与金属钾反应生成的盐。
①在K3C60晶胞中,C603-堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,K+填充在空隙中。晶胞中被K+占据的空隙百分比为___________。
②C60与金刚石互为同素异形休,比较两者的熔沸点并说明理由____________。
③C60的结构是一种多面体,如图。多面体的顶点数、面数和棱边数的关系遵循欧拉定律:顶点数+面数-棱边数=2。C60分子中所含的五边形和六边形的个数分别为_____、______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入2.0 mol X,反应X(g) ![]() Y(g)+Z(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
Y(g)+Z(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(Y)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法不正确的是
A. 反应在前250 s的平均速率为v(Y)=0.000 8 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(Y)=0.21 mol·L-1,则反应的ΔH>0
C. 相同温度下,起始时向容器中充入4.0 mol Y、4.0 mol Z,达到平衡时,则此反应的化学平衡常数为1/20
D. 相同温度下,若起始时向容器中充入2.0 mol X、0.40 mol Y和0.80 mol Z,则达到平衡前v(正)>v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com