
【题目】聚氮化硫(SN)x和K3C60是两种不同类型的超导材料。回答下列问题:
(1)在基态K原子中,能量最低的空轨道的符号是_____________。
(2)S、N、K三种元素的第一电离能由大到小的顺序是____________。
(3)(SN)x具有类似黄铜的金属光泽和导电性,其结构如下图:
![]()
以S2Cl2为原料可制取(SN)x:S2Cl2→…S4N4 ![]() S2N2
S2N2 ![]() (SN)x
(SN)x
①(SN)x中N原子的杂化方式是_________;(SN)x的晶体类型是______;
②S2Cl2的结构式为________;
③Ag元素位于周期表第5周期、IB族,基态Ag原子的价电子排布式为__________。
(4)K3C60是由足球烯(C60)与金属钾反应生成的盐。
①在K3C60晶胞中,C603-堆积方式为面心立方结构,每个晶胞中形成4个八面体空隙和8个四面体空隙,K+填充在空隙中。晶胞中被K+占据的空隙百分比为___________。
②C60与金刚石互为同素异形休,比较两者的熔沸点并说明理由____________。
③C60的结构是一种多面体,如图。多面体的顶点数、面数和棱边数的关系遵循欧拉定律:顶点数+面数-棱边数=2。C60分子中所含的五边形和六边形的个数分别为_____、______。

【答案】 3d N、S、K sp2 分子晶体 ![]() 4d105s1 100% 金刚石的熔点高。C60是分子晶体,金刚石是原子晶体,所以金刚石的熔点较高 12 20
4d105s1 100% 金刚石的熔点高。C60是分子晶体,金刚石是原子晶体,所以金刚石的熔点较高 12 20
【解析】考查物质结构与性质的综合知识的运用,(1)基态K位于第四周期IA族,按照构造原理,因此能量最低空轨道的符号是3d;(2)同周期从左向右第一电离能逐渐增大,但IIA>IIIA,VA>VIA,即N的第一电离能大于O,同主族从上到下第一电离能减小,即O的第一电离能大于S,K是活泼金属,第一电离能最小,故第一电离能的顺序是N>S>K;(3)①根据结构,N有2个σ键,1个孤电子对,价层电子对数为3,即N的杂化类型为sp2;(SN)x的晶体类型为分子晶体;②S2Cl2的结构式类似H2O2的结构式,即S2Cl2的结构式为![]() ;③Ag属于过过渡元素,价电子包括最外层电子和次外层d能级上的电子,即Ag价电子排布式为4d105s1;(4)①C603-堆积方式为面心立方结构,C603-位于顶点和面心,个数为8×18+6×1/2=4,根据化学式K3C60,K+的个数为12,K+位于空隙中,晶胞中被K+占据的空隙百分比为100%;②C60为分子晶体,金刚石为原子晶体,原子晶体的熔沸点高于分子晶体;③设五边形个数为x,六边形个数为y,根据足球烯结构,足球烯有60个顶点,面数为(x+y),每个棱被2个面共有,棱数为(3×60)/2,根据欧拉定律,有60+(x+y)-(3×60)/2=2,根据键数和顶点,得出(5x+6y)/2=(3×60)/2,推出x=12,y=20。
;③Ag属于过过渡元素,价电子包括最外层电子和次外层d能级上的电子,即Ag价电子排布式为4d105s1;(4)①C603-堆积方式为面心立方结构,C603-位于顶点和面心,个数为8×18+6×1/2=4,根据化学式K3C60,K+的个数为12,K+位于空隙中,晶胞中被K+占据的空隙百分比为100%;②C60为分子晶体,金刚石为原子晶体,原子晶体的熔沸点高于分子晶体;③设五边形个数为x,六边形个数为y,根据足球烯结构,足球烯有60个顶点,面数为(x+y),每个棱被2个面共有,棱数为(3×60)/2,根据欧拉定律,有60+(x+y)-(3×60)/2=2,根据键数和顶点,得出(5x+6y)/2=(3×60)/2,推出x=12,y=20。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组需配制含有NH![]() 、Cl-、K+、SO42-的植物培养液500 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④胶头滴管 ⑤量筒。请回答下列问题:
、Cl-、K+、SO42-的植物培养液500 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④胶头滴管 ⑤量筒。请回答下列问题:
(1)该植物培养液中,NH![]() 的物质的量浓度为__________mol·L-1;
的物质的量浓度为__________mol·L-1;
(2)该研究小组配制该植物培养液时,还须用到的玻璃实验仪器有__________、__________;
(3)甲同学用NH4Cl、(NH4)2SO4和K2SO4三种物质进行配制,则需硫酸铵的质量为__________g;
(4)若配制该培养液的其他操作均正确,则下列错误操作将使所配制溶液的浓度偏低的是__________。
a.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
b.将烧杯内的溶液向容量瓶中转移时,容量瓶中还有少量的水
c.将烧杯内的溶液向容量瓶中转移时,因操作不当使部分溶液溅出容量瓶
d.用胶头滴管向容量瓶中加水时,俯视容量瓶刻度线
e.摇匀后发现液面低于容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯(CH3CH=CH2)与溴水反应时,对反应产物的推测正确的是
A.CH2BrCH2CH2BrB.CH3CHBr2CH3
C.CH3CH2CHBrD.CH3CHBrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.1mol/L的NaClO溶液中滴加稀硫酸,HClO和ClO-所占分数(α)随pH变化的关系如图所示。下列表述不正确的是
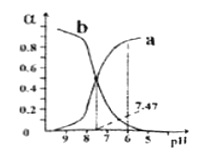
A. 曲线b代表ClO-
B. HClO的电离平衡常数Ka=10-7.47
C. pH=7时,c(Na+)>c(HClO)>c(ClO-)
D. 向pH=6的该溶液中加入少量的Na2SO3固体,c(ClO-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板(X、Y都是惰性电极),A、B是出口,通过导线与直流电源相连。请回答以下问题:
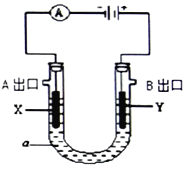
(1)若a是CuCl2溶液,则:
①X的电极名称是___________,电极反应式是_________________________。
②在B出口放一块湿润的KI-淀粉试纸会变为__________色。
(2)若a饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式是______________。在X极附近观察到的现象是_____________。
②该电解池总反应式是___________________________________。
(3)若a是400mL2mol/LCuSO4溶液,一段时间阴极增重1.28g(该极无气体放出),电解后溶液体积不变,则溶液的pH为__________,阳极可收集标况下气体__________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,在指定条件下能大量共存的离子组是
A. 无色透明溶液中:Na+ 、Cu2+ 、Cl- 、S2
B. 遇酚酞试剂变红的溶液:Fe3+ 、K+ 、SO42 、NO![]()
C. 含有大量 CO32-的溶液:K+ 、 Ba2+ 、OH- 、SO42
D. 含有大量 H+ 的溶液:Mg2+ 、NH4+ 、NO3- 、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH1=+234.1 kJ·mol-1①
C(s)+O2(g=CO2(g) ΔH2=-393.5 kJ·mol-1②
则Fe和O2反应生成Fe2O3的热化学反应方程式为_______________________________。
(2)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
①常温下NaHA溶液的pH________(填序号),原因是____________________________。
A.大于7 B.小于7 C.等于7 D.无法确定
②已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有______________________。
Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有______________________。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
(3)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.65 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.93 | 20.00 |
请完成下列填空:
①滴定达到终点的标志是_____________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为_____________________(保留两位有效数字)。
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________(填字母序号)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学电源的工作原理如图。下列说法不正确的是( )

A. 采用多孔金属作电极可增大电极接触面积,提高对气体的吸附能力
B. 通H2的电极作负极,发生氧化反应
C. 通O2的电极发生的电极反应:O2+4e-+4H+=2H2O
D. 该电池工作时发生的主要能量转化形式为化学能转化为电能和热能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com