
【题目】如图所示,A、B两个装置中的烧杯分别盛有足量的CuCl2溶液。

(1)A、B、C三个装置中属于原电池的是________(填标号,下同),属于电解池的是_____________
(2)A池中Zn是_____极,电极反应式为________;Cu是______极,电极反应式为______________,A中总反应的方程式为________________________。
(3)B池中总反应的方程式为________________。
(4)C池中Zn是____极,电极反应式为_____;Cu是______极,电极反应式为____________。
【答案】 A BC 负极 Zn-2e- == Zn2+ 正极 Cu2++2e- == Cu Zn + Cu2+ == Zn2+ +Cu CuCl2![]() Cu + Cl2↑ 阴极 Cu2++2e- == Cu 阳极 Cu-2e- == Cu2+
Cu + Cl2↑ 阴极 Cu2++2e- == Cu 阳极 Cu-2e- == Cu2+
【解析】本题考查原电池的工作原理、电解池的工作原理以及电极反应式的书写,(1)原电池没有外加电源,电解池有外加电源,因此三个装置中属于原电池的是A,属于电解池的是BC;(2)根据原电池的构成条件,Zn比铜活泼,因此锌为负极,Cu为正极,电解质溶液为CuCl2,电池总反应式为Zn+Cu2+=Zn2++Cu,负极反应式为Zn-2e-=Zn2+,正极反应式为Cu2++2e-=Cu;(3)B装置为电解池装置,两极为惰性材料为电极,电解液为CuCl2溶液,根据电解原理,总反应式为CuCl2![]() Cu + Cl2↑;(4)C装置为电解池装置,Zn与电源的负极相连,则Zn为阴极,Cu2+在阴极上先放电,电极反应式为Cu2++2e-=Cu,Cu连接电源的正极,Cu电极为阳极,Cu为活动性金属,电极反应式为Cu-2e-=Cu2+。
Cu + Cl2↑;(4)C装置为电解池装置,Zn与电源的负极相连,则Zn为阴极,Cu2+在阴极上先放电,电极反应式为Cu2++2e-=Cu,Cu连接电源的正极,Cu电极为阳极,Cu为活动性金属,电极反应式为Cu-2e-=Cu2+。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】氢氟酸是一种弱酸,可用来刻蚀玻璃,已知25℃时:
HF(aq) + OH—(aq)![]() F—(aq) + H2O(l) △H=-67.7 kJ/mol
F—(aq) + H2O(l) △H=-67.7 kJ/mol
H+(aq) + OH—(aq)![]() H2O(l) △H=-57.3kJ/mol
H2O(l) △H=-57.3kJ/mol
在10 mL 0.1mol/L的NaOH溶液中,加入10 mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是
A. 当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发)
B. 水电离的热化学方程式为:H2O(1)![]() H+(aq)+OH—(aq);△H= +57.3kJ/mol
H+(aq)+OH—(aq);△H= +57.3kJ/mol
C. 当c > 0.1时,一定不存在:c(Na+) = c(F—)
D. 若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学与环境保护的说法正确的是
A.就地在田间焚烧秸秆,减少运输成本
B.烧煤进行脱硫、脱硝处理,减少空气污染
C.推广和鼓励多使用私家车出行
D.做好空气质量预报工作,以使污染程度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓是一种低熔点高沸点的稀有金属,有“电子工业脊梁”的美誉,被广泛应用到光电子工业和微波通信工业;镓(Ga)与铝位于同一主族,金属镓的熔点是29.8℃,沸点是2403℃。
(1)工业上利用Ga(l)与NH3(g)在1000℃高温下合成半导体固体材料氮化镓(GaN),同时生成氢气,每生成lmol H2时放出10.3 kJ热量。写出该反应的热化学方程式__________________。
(2)在密闭容器中,充入一定量的Ga与NH3发生反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。
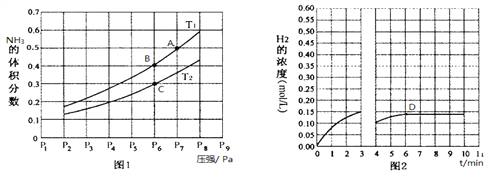
① 图1中A点和C点化学平衡常数的大小关系是:KA_____KC,(填“<”、“=”或“>”),理由是__________________________________________________。
② 该反应在T1和P6条件下至3min时达到平衡,此时改变条件并于D点处重新达到平衡,H2的浓度随反应时间的变化趋势如图2所示(3~4 min的浓度变化未表示出来),则改变的条件为__________(仅改变温度或压强中的一种)。
(3)若用压强平衡常数Kp表示,此时B点对应的Kp=__________(用含P6的式子表示)(Kp为压强平衡常数,用平衡分压代替平衡浓度计算,气体平衡分压=总压×气体体积分数)
(4)电解精炼法提纯镓的具体原理如下:以粗镓(含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH溶液为电解质。在电流作用下使粗镓溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+。电解精炼镓时阳极泥的成分是_________。
②阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,写出GaO2-在阴极放电的电极反应式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
A. W2-、X+ B. X+、Y3+
C. Y3+、Z2- D. X+、Z2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是()
A. 在25℃ 101KPa时,11.2 L氢气含有0.5 NA个氢分子
B. 标准状况下,20 L的N2和2.4 L的O2所含分子总数约为NA
C. 在标准状况下,18 g 水含有电子数为8 NA
D. 在25℃ 101KPa时,1 mol 氦气含有2 NA 个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用麻醉药苄佐卡因和食品防腐剂J可由芳香烃A(质谱图显示其最大质荷比为92)来制备,其合成路线如下:
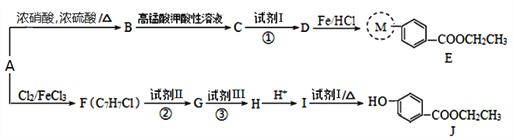
已知:I.M代表E分子结构中的一部分; II.![]()
请回答下列问题:
(1)C的化学名称是____________;E中所含官能团的名称是______________。
(2)由A生成B和B生成C的反应类型分别为_________、__________
(3)C能与NaHCO3溶液反应,反应①的化学方程式是_________________。
(4)反应②、③中试剂II和试剂III依次是___________。(填序号)
A.高锰酸钾酸性溶液、氢氧化钠溶液
B.氢氧化钠溶液、高锰酸钾酸性溶液
(5)J有多种同分异构体,写出一种符合下列要求的同分异构体的结构简式:_______________。
a.为苯的二元取代物,其中一个取代基为羟基;
b.与J具有相同的官能团,且能发生银镜反应。
(6)写出以A为起始原料,合成涂改液的主要成分亚甲基环己烷 ( ![]() ) 的合成路线(其他无机试剂任选):______________________
) 的合成路线(其他无机试剂任选):______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是
A. H2、I2(g)、HI平衡混合气体加压后颜色变深(已知:H2 +I2(g)![]() 2HI)
2HI)
B. 合成氨时,将混合气体中的NH3液化有利于提高产率
C. 实验室用排饱和食盐水的方法收集氯气
D. 滴加酚酞的氨水中加入氯化铵固体后红色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,SO2表现氧化性的是( )
A.SO2与水反应
B.SO2与H2S溶液反应
C.SO2与NaOH溶液反应
D.SO2与酸性高锰酸钾溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com