
【题目】下列有关化学与环境保护的说法正确的是
A.就地在田间焚烧秸秆,减少运输成本
B.烧煤进行脱硫、脱硝处理,减少空气污染
C.推广和鼓励多使用私家车出行
D.做好空气质量预报工作,以使污染程度减小
科目:高中化学 来源: 题型:
【题目】下列实验现象与实验结论或原理不一致的是
选项 | 实验现象 | 实验结论或原理 |
A | 生活中用泡沫灭火器灭火 | 3HCO3-+Al3+===Al(OH)3↓+3CO2↑ |
B | 向AgCl悬浊液中滴入少量KI溶液,有黄色沉淀生成 | 说明KSP(AgCl)>KSP(AgI) |
C | 向NaHS溶液中滴入酚酞,溶液变红色 | HS-水解程度大于电离程度 |
D | Na2CO3溶液中滴加酚酞呈红色 | CO32-+2H2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将二氧化硫通入到氯化钡溶液中未见到明显现象,把上述溶液分为两份,其中一份a加入NaOH溶液,另一份b中通入Cl2 , 均有白色沉淀产生,其中a中沉淀的化学式为 , b中沉淀的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A. 0.1 mol/L的(NH4)2SO4溶液中:c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B. 0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO![]() )+c(H2CO3)+2c(CO
)+c(H2CO3)+2c(CO![]() )
)
C. 将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D. 在25℃0.1 mol/L的 NH4Cl溶液中:c(Cl-)=c(NH![]() )+c(NH3·H2O)
)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙三名同学分别进行氢氧化铁胶体的制备实验。
甲同学:向1 mol·L-1的氯化铁溶液中加少量氢氧化钠溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25 mL沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
(1)其中操作正确的同学是____________,若丙同学实验中不停止加热,会看到___________。
(2)氢氧化铁胶体制备的化学方程式为_______________________________;
(3)证明有氢氧化铁胶体生成利用的胶体性质是_______,提纯所制氢氧化铁胶体常用的方法是________。
(4)利用氢氧化铁胶体进行实验:
①将其装入U形管内,用石墨作电极,通电一段时间后发现与电源负极相连的电极区附近的颜色逐渐变深,这表明氢氧化铁胶体微粒带__________(填“正”或“负”)电荷;
②若向其中加入饱和硫酸钠溶液,产生的现象是________________________;
③若向其中逐滴加入稀盐酸,产生的现象是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B两个装置中的烧杯分别盛有足量的CuCl2溶液。

(1)A、B、C三个装置中属于原电池的是________(填标号,下同),属于电解池的是_____________
(2)A池中Zn是_____极,电极反应式为________;Cu是______极,电极反应式为______________,A中总反应的方程式为________________________。
(3)B池中总反应的方程式为________________。
(4)C池中Zn是____极,电极反应式为_____;Cu是______极,电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浅绿色晶体X[x(NH4)2SO4·yFeSO4·zH2O]在分析化学中常用作还原剂. 为确定其组成,某小组同学进行如下实验.
I.NH4+的测定
采用蒸馏法,蒸馏装置如图所示。
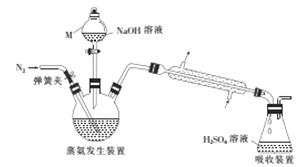
相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入三颈烧瓶中;
②准确量取50.00mL3.0300molL-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶;
④用0.120molL-1NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶液.
(1)仪器M的名称为__________。
(2)步骤③中,发生的氧化还原反应的化学方程式为____________。蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是_____________。
(3)步骤④中,若振荡时锥形瓶中有液体溅出,则所测得的n(NH4+)的值将______(填“偏大”“偏小”或“不变”)。
II.SO42-含量的测定
采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X 于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重、称量,得沉淀质量为69.90g。
(4)步骤①中,判断BeCl 溶液已过量的实验操作和现象是___________。
(5)步骤②中,采用冷水洗讓沉淀,其主要目的是___________。
(6)结合实验Ⅰ、Ⅱ通过计算得出晶体X的化学式为__________。实验I 的步骤①中,溶液中离子溶度由大到小的顺序为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com