
【题目】某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是_______,说明氧化性Ag+>Cu2+。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
实验 | 试剂 | 编号及现象 | |
试管 | 滴管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
① 经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
② 经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:
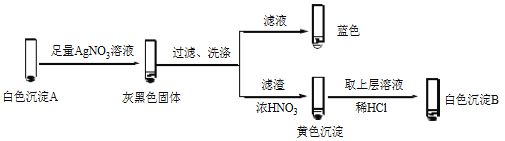
a.检验滤液无I2。溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是____,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
编号 | 实验1 | 实验2 | 实验3 |
实验 |
|
|
|
现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极 上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黄色的原因是_______(用电极反应式表示)。
② “实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_______。
③ 方案2中,Cu2+能氧化I-,而Ag+未能氧化I-的原因:_______。
(资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108)
【答案】 ![]() AgI
AgI ![]() AgCl
AgCl ![]()
![]() 将d烧杯内的溶液换为pH≈4的1 mol/L
将d烧杯内的溶液换为pH≈4的1 mol/L ![]() 溶液,c中溶液较慢变浅黄,电流计指针偏转 K1>K2,故
溶液,c中溶液较慢变浅黄,电流计指针偏转 K1>K2,故![]() 更易与
更易与![]() 发生复分解反应,生成AgI。2Cu2+ + 4I- = 2CuI + I2 ,生成了CuI沉淀,使得
发生复分解反应,生成AgI。2Cu2+ + 4I- = 2CuI + I2 ,生成了CuI沉淀,使得![]() 的氧化性增强
的氧化性增强
【解析】(1)向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝,说明铜置换出了金属银,反应的离子方程式为![]() ,说明氧化性Ag+>Cu2+,故答案为:
,说明氧化性Ag+>Cu2+,故答案为:![]() ;
;
(2)① 经检验,Ⅰ中溶液不含I2,黄色沉淀是碘离子与银离子形成的碘化银沉淀,故答案为:AgI;
②Ⅱ中溶液含I2,说明Cu2+做氧化剂,将碘离子氧化,本身被还原为Cu+,因此白色沉淀A是CuI。
a.检验滤液无I2。溶液呈蓝色说明溶液含有Cu2+,故答案为:Cu2+;
b.滤渣用浓硝酸溶解后,在上层清液中加入盐酸,生成的白色沉淀B为AgCl,故答案为:AgCl;
c.白色沉淀A与AgNO3溶液反应生成了Cu2+和灰黑色沉淀,灰黑色沉淀用浓硝酸溶解后的溶液中含有银离子,黄色沉淀为AgI,说明灰黑色沉淀中含有金属银,反应的离子方程式为![]() ,说明氧化性Ag+>Cu2+,故答案为:
,说明氧化性Ag+>Cu2+,故答案为:![]() ;
;
(3)①碘化钾溶液与硝酸银溶液构成了原电池,a中溶液中的碘离子发生氧化反应生成碘单质,溶液呈棕黄色,电极反应式为![]() ,故答案为:
,故答案为:![]() ;
;
② “实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,只需设计没有铜离子的情况下,也能看到相似的现象即可,可以设计实验:将d烧杯内的溶液换为pH≈4的1 mol/L ![]() 溶液,c中溶液较慢变浅黄,电流计指针偏转,故答案为:将d烧杯内的溶液换为pH≈4的1 mol/L
溶液,c中溶液较慢变浅黄,电流计指针偏转,故答案为:将d烧杯内的溶液换为pH≈4的1 mol/L ![]() 溶液,c中溶液较慢变浅黄,电流计指针偏转;
溶液,c中溶液较慢变浅黄,电流计指针偏转;
③Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108,K1>K2,故![]() 更易与
更易与![]() 发生复分解反应,生成AgI。2Cu
发生复分解反应,生成AgI。2Cu![]() 的氧化性增强,因此方案2中,Cu2+能氧化I-,而Ag+未能氧化I-,故答案为:K1>K2,故
的氧化性增强,因此方案2中,Cu2+能氧化I-,而Ag+未能氧化I-,故答案为:K1>K2,故![]() 更易与
更易与![]() 发生复分解反应,生成AgI。2Cu2+ + 4I- = 2CuI + I2 ,生成了CuI沉淀,使得
发生复分解反应,生成AgI。2Cu2+ + 4I- = 2CuI + I2 ,生成了CuI沉淀,使得![]() 的氧化性增强。
的氧化性增强。


科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL-1 | 溶质的质量分数 | 溶液的密度/gcm-3 | |
硫酸 | c1 | w1 | ρ1 |
氨水 | c2 | w2 | ρ2 |

(1)表中硫酸的质量分数w1为_____(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1mol·L-1质量分数为w1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为_______mol·L-1,质量分数_______w1/2(填“大于”、“小于”或“等于”,下同)。
(3)质量分数为w2的氨水与w2/5的氨水等质量混合,所得溶液的密度_____ρ2 gcm-3。
(4)标况下700体积的氨气溶解于1体积水中形成氨水饱和溶液,溶液的密度为d g/cm3,则该溶液的物质的量浓度为________(用含有d的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)
A. 11.52 B. 11.70
C. 11.82 D. 12.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氟酸是一种弱酸,可用来刻蚀玻璃,已知25℃时:
HF(aq) + OH—(aq)![]() F—(aq) + H2O(l) △H=-67.7 kJ/mol
F—(aq) + H2O(l) △H=-67.7 kJ/mol
H+(aq) + OH—(aq)![]() H2O(l) △H=-57.3kJ/mol
H2O(l) △H=-57.3kJ/mol
在10 mL 0.1mol/L的NaOH溶液中,加入10 mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是
A. 当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发)
B. 水电离的热化学方程式为:H2O(1)![]() H+(aq)+OH—(aq);△H= +57.3kJ/mol
H+(aq)+OH—(aq);△H= +57.3kJ/mol
C. 当c > 0.1时,一定不存在:c(Na+) = c(F—)
D. 若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年12月19日,中国绿色碳汇基金会印发《关于授予江口县“碳汇城市”称号的决定》。我市江口县成为全国第三个、我省首个“碳汇城市”。碳汇,是指通过植树造林、森林管理、植被恢复等措施,利用植物光合作用吸收大气中的二氧化碳6CO2(g) +6H2O(l) === C6H12O6(s)+6O2(g) ,并将其固定在植被和土壤中,从而减少温室气体在大气中浓度的过程、活动或机制。已知每吸收1molCO2需要吸收能量约为470kJ.据此回答下列问题:
(1)碳汇过程中能量的转化形式由__________能转化为___________能;据相关资料表明,每1m3林木,大约能吸收能量为1.88×107kJ,大约可以吸收CO2______吨;葡萄糖燃烧的热化学方程式为:_____________ 。
(2)工业废气中的CO2可用碱液吸收。所发生的反应如下:
CO2(g)+2NaOH(aq)===Na2CO3(aq)+H2O(l) ΔH=-a kJ·mol-1
CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-b kJ·mol-1
则:①反应CO2(g)+H2O(l)+Na2CO3(aq)===2NaHCO3(aq)的ΔH=______ kJ·mol-1(用含a、b的代数式表示)。
(3)生产液晶显示器的过程中使用的化学清洗剂NF3和CO2一样是一种温室气体 ,在大气中的寿命可长达740年之久。以下是几种化学键的键能:
化学键 | N≡N | F—F | N—F |
键能/kJ·mol-1 | 941.7 | 154.8 | 283.0 |
①反应:N2(g)+3F2(g)=2NF3(g)ΔH=_________________
②下列说法中不正确的有_____________
A.过程:N2(g)![]() 2N放出能量
2N放出能量
B.过程:N+3F![]() NF3(g)放出能量
NF3(g)放出能量
C.使用催化剂能减小反应的ΔH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组为测定钠元素的相对原子质量,设计的装置如图所示,该装置(包括水和干燥剂)的总质量为ag,从实验室取出bg(不足量)钠放入水中,塞紧瓶塞,完全反应后再称量此装置的总质量为cg。试回答:

(1)实验室取用一小块钠,需要用到__________________实验仪器。
(2)此干燥管的作用是________________________;若此钠块有极少量被氧化,则测出的相对原子质量会比实际相对原子质量________(填“偏大”、“偏小”或“不变”)。
(3)有甲同学建议在图中干燥管上再连一同样干燥管,其目的是____________________,计算钠的相对原子质量的表达式为____________________。
(4)有乙同学为避免由于行动不够迅速产生偏差,又建议在集气瓶中再加入一定量煤油,其目的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是()
A. 在25℃ 101KPa时,11.2 L氢气含有0.5 NA个氢分子
B. 标准状况下,20 L的N2和2.4 L的O2所含分子总数约为NA
C. 在标准状况下,18 g 水含有电子数为8 NA
D. 在25℃ 101KPa时,1 mol 氦气含有2 NA 个原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com