
【题目】能使水的电离平衡右移,且水溶液显酸性的微粒是
A. Al3+ B. OH- C. H+ D. HCO3-
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】已知亚硒酸(H2SeO3)为二元弱酸,常温下,向某浓度的亚硒酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中H2SeO3、HSeO3-、SeO32-三种微粒的物质的量分数与溶液pH 的关系如图所示。下列说法不正确的是( )
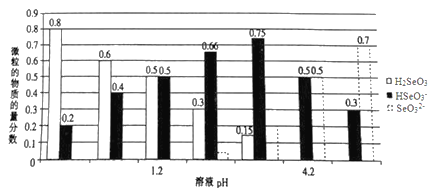
A. 将相同物质的量NaHSeO3和Na2SeO3 固体完全溶于水可配得pH为4.2的混合液
B. pH=l.2的溶液中:c(Na+)+c(H+)=c(OH-)+c(H2SeO3)
C. 常温下,亚硒酸的电离平衡常数K2=10-4.2
D. 向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中水的电离程度一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年采用中国自主知识产权的全球首套煤基乙醇工业化项目投产成功。某地煤制乙醇的过程表示如下。
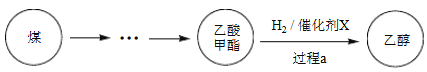
(1)Cu(NO3)2是制备“催化剂X”的重要试剂。

① 气体A是_______。
② 实验室用Cu(NO3)2固体配制溶液,常加入少量稀HNO3。运用化学平衡原理简述HNO3的作用_______。
③ NaClO溶液吸收气体A的离子方程式是_______。
(2)过程a包括以下3个主要反应:
Ⅰ.CH3COOCH3(g)+2H2(g)![]() C2H5OH(g)+CH3OH(g) ΔH1
C2H5OH(g)+CH3OH(g) ΔH1
Ⅱ.CH3COOCH3(g)+C2H5OH(g)![]() CH3COOC2H5 (g)+CH3OH(g) ΔH2
CH3COOC2H5 (g)+CH3OH(g) ΔH2
Ⅲ.CH3COOCH3(g)+H2(g)![]() CH3CHO(g)+CH3OH(g) ΔH3
CH3CHO(g)+CH3OH(g) ΔH3
相同时间内,测得CH3COOCH3转化率、乙醇和乙酸乙酯的选择性(如乙醇选择性= ![]() )如下图所示。
)如下图所示。
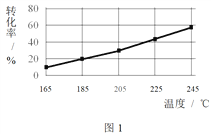
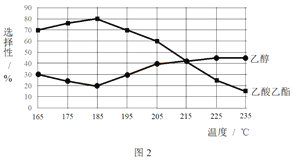
① 已知:ΔH1 < 0。随温度降低,反应Ⅰ化学平衡常数的变化趋势是_______。
② 下列说法不合理的是________。
A.温度可影响反应的选择性
B.225℃~235℃,反应Ⅰ处于平衡状态
C.增大H2的浓度,可以提高CH3COOCH3的转化率
③ 为防止“反应Ⅲ”发生,反应温度应控制的范围是_______。
④ 在185℃下,CH3COOCH3起始物质的量为5 mol,生成乙醇的物质的量是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是_______,说明氧化性Ag+>Cu2+。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
实验 | 试剂 | 编号及现象 | |
试管 | 滴管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
① 经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
② 经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:
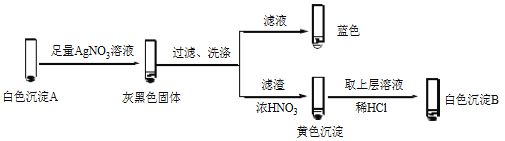
a.检验滤液无I2。溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是____,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
编号 | 实验1 | 实验2 | 实验3 |
实验 |
|
|
|
现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极 上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黄色的原因是_______(用电极反应式表示)。
② “实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_______。
③ 方案2中,Cu2+能氧化I-,而Ag+未能氧化I-的原因:_______。
(资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷是第VA族的元素,它们的单质及其化合物在生产生活中均有重要作用。请回答以下问题:
(1) 基态砷原子的最外层电子排布式为______;有_____个能级。
(2) N、P、As原子的第一电离能由大到小的顺序为________。
(3) 氮元素的一种重要化合物尿素CO(NH2)2分子中,σ键和π键的数目之比为______。
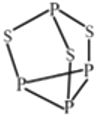
(4) P4S3 可用于制造火柴,其分子结构如图所示,判断P4S3 分子中硫原子的杂化轨道类型为_____,每个P4S3 分子中含孤电子对的数目为_______。
(5) Na3AsO4 可用作杀虫剂,AsO43-的空间构型为_______,与AsO43-互为等电子体的一种分子为_____ (填写化学式)。
(6) ①砷化镓(GaAs) 为黑灰色固体,熔点为1238℃,其晶胞结构如图所示。该晶体属于____晶体,微粒之间存在的作用力是_______。

② 砷化镓晶胞中距离Ga原子等距且最近的Ga原子有______个,已知砷化镓晶胞边长为apm,其密度为ρg·cm-3,则阿伏加德罗常数的值_______(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将二氧化硫通入到氯化钡溶液中未见到明显现象,把上述溶液分为两份,其中一份a加入NaOH溶液,另一份b中通入Cl2 , 均有白色沉淀产生,其中a中沉淀的化学式为 , b中沉淀的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组需配制含有NH![]() 、Cl-、K+、SO42-的植物培养液500 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④胶头滴管 ⑤量筒。请回答下列问题:
、Cl-、K+、SO42-的植物培养液500 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④胶头滴管 ⑤量筒。请回答下列问题:
(1)该植物培养液中,NH![]() 的物质的量浓度为__________mol·L-1;
的物质的量浓度为__________mol·L-1;
(2)该研究小组配制该植物培养液时,还须用到的玻璃实验仪器有__________、__________;
(3)甲同学用NH4Cl、(NH4)2SO4和K2SO4三种物质进行配制,则需硫酸铵的质量为__________g;
(4)若配制该培养液的其他操作均正确,则下列错误操作将使所配制溶液的浓度偏低的是__________。
a.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
b.将烧杯内的溶液向容量瓶中转移时,容量瓶中还有少量的水
c.将烧杯内的溶液向容量瓶中转移时,因操作不当使部分溶液溅出容量瓶
d.用胶头滴管向容量瓶中加水时,俯视容量瓶刻度线
e.摇匀后发现液面低于容量瓶刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com