
【题目】下列各组混合物中.能用分液漏斗分离的是( )
A.酒情和水
B.碘和四氯化碳
C.水和四氯化碳
D.硫单质和二硫化碳
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】合成气(CO和H2)是目前化工常用的原料,下面是用甲烷制备合成气的两种方法:
① CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
② 2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。
2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。
其中一个反应的反应过程与能量变化关系如图所示。则下列说法正确的是( )

A. E1表示2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g)的活化能
2CO(g)+4H2(g)的活化能
B. E2表示CH4(g)+H2O(g)![]() CO(g)+3H2(g)的活化能
CO(g)+3H2(g)的活化能
C. 该图示为反应②的反应过程与能量变化示意图
D. 一般情况下,加入催化剂,既能降低E1,也能降低E2,但不能改变E1与E2的差值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定条件下,CO2(g)+3H2(g)![]() CH3OH (g)+H2O(g) △H=-57.3 kJ/mol,往 2L 恒容密闭容器中充入 1 mol CO2和3 mol H2,在不同催化剂作用下发生反应①、反应②与反应③,相同时间内CO2的转化率随温度变化如下图所示,b点反应达到平衡状态,下列说法正确的是
CH3OH (g)+H2O(g) △H=-57.3 kJ/mol,往 2L 恒容密闭容器中充入 1 mol CO2和3 mol H2,在不同催化剂作用下发生反应①、反应②与反应③,相同时间内CO2的转化率随温度变化如下图所示,b点反应达到平衡状态,下列说法正确的是
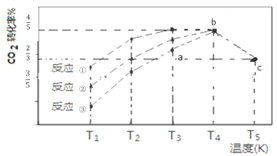
A. a 点 v(正)>v(逆)
B. b点反应放热53.7 kJ
C. 催化剂效果最佳的反应是③
D. c点时该反应的平衡常数K=4/3(mol-2![]() L-2)
L-2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
选项 | A | B | C | D |
实验 | 用CCl4提取溴水中的Br2 | 石油的分馏 | 从KI和I2的固体混合物中回收I2 | 配制100mL0.1000 mol·L-1 KCl溶液 |
装置或仪器 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清洁能源氢气制取与储存是氢能源利用领域的研究热点.
已知:①CH4(g)+ H2O(g)![]() CO(g)+3H2(g) △H =+206.2kJ·mol-1
CO(g)+3H2(g) △H =+206.2kJ·mol-1
②CH4(g)+ CO2(g)![]() 2CO(g)+2H2(g) △H =+247.4kJ·mol-1
2CO(g)+2H2(g) △H =+247.4kJ·mol-1
③2H2S(g)![]() 2H2(g)+S2(g) △H =+169.8kJ·mol-1
2H2(g)+S2(g) △H =+169.8kJ·mol-1
请按要求回答下列问题
(1)以甲烷为原料制取氢气是工业上常用的制氢方法.CH4与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________________.
(2)在密闭容器中充入一定量的H2S,发生反应③。如图所示为H2S气体的平衡转化率与温度、压强的关系。
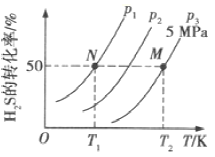
①图中压强(P1、P2、P3)的大小顺序为______,该反应平衡常数的大小关系为K(T1)_____填(“>”“<”或“=”)K(T2)。
②如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有_________。
(3)硫化氢是剧毒气体,尾气中硫化氢有多种处理方法:
①碱溶液吸收。用150 ml 2.0 mol![]() L-1的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液X(显碱性)。X溶液中离子浓度的大小关系正确的是_____(填选项字母)。
L-1的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液X(显碱性)。X溶液中离子浓度的大小关系正确的是_____(填选项字母)。
A.c()c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+)
B.c(Na+)+c(H+)=c(OH-)+ c(HS-)+ c(S2-)
C.2c(Na+)=3[c(H2S)+c(HS-)+ c(S2-)]
D.c(OH-)= c(H+)+ c(HS-)+2 c(H2S)
②纯碱溶液吸收,写出该吸收法发生反应的离子方程式_________________________。已知H2CO3和H2S在25℃时的电离常数如表所示:

③硫酸铜溶液吸收。200mL0.05 mol/ L的CuSO4溶液吸收液中H2S,恰好使反应溶液中Cu2+和S2-浓度相等的溶液中c(Cu2+)为___________________(已知常温下,Ksp(CuS)≈1.0×10-36)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)制取氯气时,在烧瓶中先加入一定量的二氧化锰固体,再通过__________(填写仪器名称)向烧瓶中加入适量的____________(填写试剂名称)。写出该反应的化学方程式并用双线桥法标出电子转移的方向和数目_________________________。
(2)为除去氯气中混有的杂质气体,可在①和②之间安装盛有__________(选填字母编号)的净化装置。
a. 碱石灰 b. 饱和食盐水 c. 浓硫酸 d. 饱和碳酸氢钠溶液
(3)③中发生反应的化学方程式______________________________________。比较制取氯酸钾和次氯酸钠的条件,可以初步得到的结论是:_____________________。
(4)反应完毕经冷却后,②的试管中有大量晶体析出,图中符合该晶体溶解度随温度变化规律的曲线是___________(选填字母);从②的试管中分离该晶体的操作是___________ (填写实验操作名称)。

(5)实验中可观察到④的试管中溶液颜色会发生变化:最初溶液由紫色变为 _______,随后溶液逐渐变为无色,是因为发生了反应______________(写化学方程式)。
(6)一定量的氢气在过量氯气中燃烧,所得的混合物用100mL 3.00mol/L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。所得溶液中Cl-的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚硒酸(H2SeO3)为二元弱酸,常温下,向某浓度的亚硒酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中H2SeO3、HSeO3-、SeO32-三种微粒的物质的量分数与溶液pH 的关系如图所示。下列说法不正确的是( )
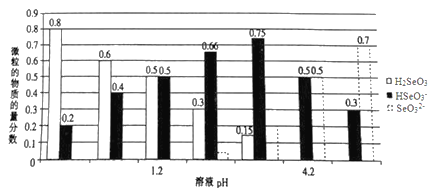
A. 将相同物质的量NaHSeO3和Na2SeO3 固体完全溶于水可配得pH为4.2的混合液
B. pH=l.2的溶液中:c(Na+)+c(H+)=c(OH-)+c(H2SeO3)
C. 常温下,亚硒酸的电离平衡常数K2=10-4.2
D. 向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中水的电离程度一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]石油裂解气用途广泛,可用于合成各种橡胶和医药中间体。利用石油裂解气合成CR橡胶和医药中间体K的线路如下:
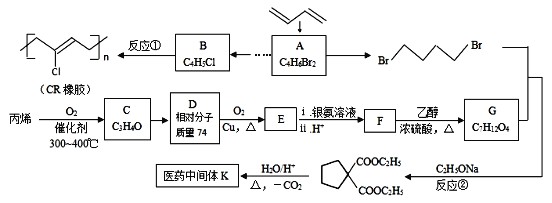
已知: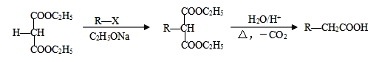
(1)A的反式异构体的结构简式为_________________;
(2)用系统命名法给B命名,其名称是_________________;
(3)C、D、E均为链状结构,且均能与新制氢氧化铜悬浊液共热生成砖红色沉淀,则C中不含氧的官能团名称是_________________, 写出反应D→E的化学方程式_________________;
(4)K的结构简式为_________________;
(5)写出F与乙二醇发生聚合反应的化学方程式______________________________;
(6)写出同时满足下列条件的医药中间体K的所有同分异构体的结构简式___________;
a.与E互为同系物 b.核磁共振氢谱有3种峰
(7)已知双键上的氢原子很难发生取代反应。以A为起始原料,选用必要的无机试剂合成B,写出合成路线:______________________________________________________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是_______,说明氧化性Ag+>Cu2+。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
实验 | 试剂 | 编号及现象 | |
试管 | 滴管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
① 经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
② 经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:
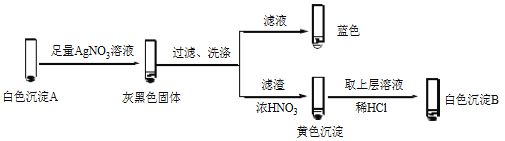
a.检验滤液无I2。溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是____,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
编号 | 实验1 | 实验2 | 实验3 |
实验 |
|
|
|
现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极 上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黄色的原因是_______(用电极反应式表示)。
② “实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_______。
③ 方案2中,Cu2+能氧化I-,而Ag+未能氧化I-的原因:_______。
(资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com