
【题目】[化学——选修5:有机化学基础]石油裂解气用途广泛,可用于合成各种橡胶和医药中间体。利用石油裂解气合成CR橡胶和医药中间体K的线路如下:
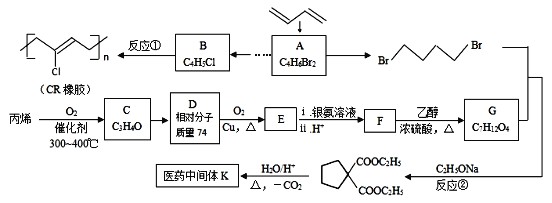
已知: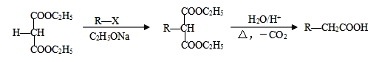
(1)A的反式异构体的结构简式为_________________;
(2)用系统命名法给B命名,其名称是_________________;
(3)C、D、E均为链状结构,且均能与新制氢氧化铜悬浊液共热生成砖红色沉淀,则C中不含氧的官能团名称是_________________, 写出反应D→E的化学方程式_________________;
(4)K的结构简式为_________________;
(5)写出F与乙二醇发生聚合反应的化学方程式______________________________;
(6)写出同时满足下列条件的医药中间体K的所有同分异构体的结构简式___________;
a.与E互为同系物 b.核磁共振氢谱有3种峰
(7)已知双键上的氢原子很难发生取代反应。以A为起始原料,选用必要的无机试剂合成B,写出合成路线:______________________________________________________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
【答案】 ![]() 2-氯-1,3-丁二烯 碳碳双键 2 CH2OHCH2CHO+O2
2-氯-1,3-丁二烯 碳碳双键 2 CH2OHCH2CHO+O2![]() 2OHCCH2CHO +2H2O
2OHCCH2CHO +2H2O ![]()
![]()
(条件写浓硫酸加热可逆号也正确) 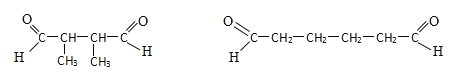
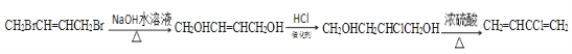
【解析】根据流程图,1,3-丁二烯与溴发生1,4加成,生成A,A为1,4-二溴-2-丁烯(![]() );与氢气加成后生成1,4-二溴丁烷(
);与氢气加成后生成1,4-二溴丁烷(![]() );丙烯催化氧化生成C,C为CH2=CHCHO,D的相对分子质量比C大18,说明C与水加成生成D,D为
);丙烯催化氧化生成C,C为CH2=CHCHO,D的相对分子质量比C大18,说明C与水加成生成D,D为![]() ,催化氧化生成E(丙二醛),与银氨溶液反应生成F(丙二酸),与乙醇酯化反应生成G(
,催化氧化生成E(丙二醛),与银氨溶液反应生成F(丙二酸),与乙醇酯化反应生成G(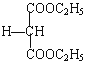 );根据信息,G(
);根据信息,G( )与
)与![]() 反应生成
反应生成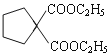 ,进一步反应生成K(
,进一步反应生成K(![]() )。
)。
(1)根据以上分析可知:A为1,4-二溴-2-丁烯(![]() ),其反式异构体的结构简式为
),其反式异构体的结构简式为![]() ;正确答案:
;正确答案: ![]() 。
。
(2)根据CR橡胶的结构简式可知,形成该高分子的单体为2-氯-1,3-丁二烯,所以有机物B为2-氯-1,3-丁二烯;正确答案:2-氯-1,3-丁二烯。
(3)C为CH2=CHCHO,含有的不含氧官能团为碳碳双键;有机物D为CH2OHCH2CHO,在铜作催化剂条件下,发生催化氧化变为醛,化学方程式为:2CH2OHCH2CHO+O2![]() 2OHCCH2CHO +2H2O ;正确答案:2CH2OHCH2CHO+O2
2OHCCH2CHO +2H2O ;正确答案:2CH2OHCH2CHO+O2![]() 2OHCCH2CHO +2H2O 。
2OHCCH2CHO +2H2O 。
(4)根据信息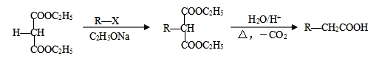 可知,有机物
可知,有机物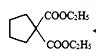
![]()
![]() ;因此K的结构简式为
;因此K的结构简式为![]() ;正确答案:
;正确答案:![]() 。
。
(5)F为丙二酸,丙二酸与乙二醇发生聚合反应的化学方程式为nHOOCCH2COOH+nHOCH2CH2OH![]() HO
HO![]() COCH2COOCH2CH2O
COCH2COOCH2CH2O![]() H+(2n-1) H2O;正确答案:nHOOCCH2COOH+nHOCH2CH2OH
H+(2n-1) H2O;正确答案:nHOOCCH2COOH+nHOCH2CH2OH![]() HO
HO![]() COCH2COOCH2CH2O
COCH2COOCH2CH2O![]() H+(2n-1) H2O。
H+(2n-1) H2O。
(6)K为![]() ,a.与E互为同系物,含有两个醛基;b.核磁共振氢谱有3种峰;满足条件的医药中间体K的同分异构体的结构简式有
,a.与E互为同系物,含有两个醛基;b.核磁共振氢谱有3种峰;满足条件的医药中间体K的同分异构体的结构简式有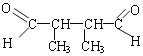 、
、![]() ;正确答案:
;正确答案: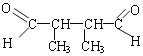 、
、![]() 。
。
(7)A为![]() ,B为
,B为![]() ;以A为起始原料,选用必要的无机试剂合成B,由于已知双键上的氢原子很难发生取代反应,首先将有机物A中的溴原子水解为羟基,再与氯化氢加成生成
;以A为起始原料,选用必要的无机试剂合成B,由于已知双键上的氢原子很难发生取代反应,首先将有机物A中的溴原子水解为羟基,再与氯化氢加成生成![]() ,然后将羟基消去即可,故合成路线为:
,然后将羟基消去即可,故合成路线为: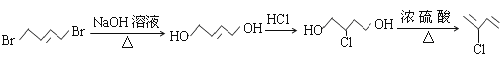 ;正确答案:
;正确答案: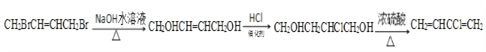 。
。


科目:高中化学 来源: 题型:
【题目】碳、氧、氮、镁、铬、铁、铜是几种重要的元素,请回答下列问题:
(1)在第二周期的元素中,第一电离能介于B与N之间的元素有_________种。
(2)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是____________________。
(3)Fe与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ键与π键个数比为______________。请写出一个与CO互为等电子体的离子:____________________。
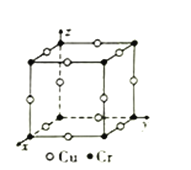
(4)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Cr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+。
①K2Cr2O7具有很强的氧化性,能直接将CH3CH2OH氧化成CH3COOH,试写出基态铬原子的价层电子排布式:_______________;CH3COOH分子中碳原子的杂化类型为_________________;乙醇和丙烷相对分子质量相近,但乙醇的熔、沸点比丙烷高很多,试解释其主要原因:____________________________________。
②该配离子[Cr(H2O)3(NH3)3]3+中,中心离子的配位数为_______,NH3的VSEPR模型为_______。
③图为Cu-Cr形成的一种合金的晶胞(假设晶体中原子之间彼此相切),单独属于该晶胞的Cu原子共有三个,其原子坐标可分别表示为:(![]() ,0,0)、(0,
,0,0)、(0, ![]() ,0)、_______;已知晶胞中Cr和Cu原子间的最近距离为
,0)、_______;已知晶胞中Cr和Cu原子间的最近距离为![]() apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
D.将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL-1 | 溶质的质量分数 | 溶液的密度/gcm-3 | |
硫酸 | c1 | w1 | ρ1 |
氨水 | c2 | w2 | ρ2 |

(1)表中硫酸的质量分数w1为_____(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1mol·L-1质量分数为w1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为_______mol·L-1,质量分数_______w1/2(填“大于”、“小于”或“等于”,下同)。
(3)质量分数为w2的氨水与w2/5的氨水等质量混合,所得溶液的密度_____ρ2 gcm-3。
(4)标况下700体积的氨气溶解于1体积水中形成氨水饱和溶液,溶液的密度为d g/cm3,则该溶液的物质的量浓度为________(用含有d的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)
A. 11.52 B. 11.70
C. 11.82 D. 12.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组为测定钠元素的相对原子质量,设计的装置如图所示,该装置(包括水和干燥剂)的总质量为ag,从实验室取出bg(不足量)钠放入水中,塞紧瓶塞,完全反应后再称量此装置的总质量为cg。试回答:

(1)实验室取用一小块钠,需要用到__________________实验仪器。
(2)此干燥管的作用是________________________;若此钠块有极少量被氧化,则测出的相对原子质量会比实际相对原子质量________(填“偏大”、“偏小”或“不变”)。
(3)有甲同学建议在图中干燥管上再连一同样干燥管,其目的是____________________,计算钠的相对原子质量的表达式为____________________。
(4)有乙同学为避免由于行动不够迅速产生偏差,又建议在集气瓶中再加入一定量煤油,其目的是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com