
����Ŀ��̼����������þ����������ͭ�Ǽ�����Ҫ��Ԫ�أ���ش��������⣺
��1���ڵڶ����ڵ�Ԫ���У���һ�����ܽ���B��N֮���Ԫ����_________�֡�
��2������������Ϸ���MgO���۵��CuO���۵�ߵö࣬��ԭ����____________________��
��3��Fe��CO���γ�һ����Ҫ�Ĵ���Fe(CO)5���÷���������������������Ϊ______________����д��һ����CO��Ϊ�ȵ���������ӣ�____________________��
��4����������һ������ɫ����Ӳ����ʴ�Ľ��������Ļ���������࣬�磺Cr2(SO4)3��K2Cr2O7�Լ�������[Cr(H2O)3(NH3)3]3+��
��K2Cr2O7���к�ǿ�������ԣ���ֱ�ӽ�CH3CH2OH������CH3COOH����д����̬��ԭ�ӵļ۲�����Ų�ʽ��_______________��CH3COOH������̼ԭ�ӵ��ӻ�����Ϊ_________________;�Ҵ��ͱ�����Է���������������Ҵ����ۡ��е�ȱ���ߺܶ࣬�Խ�������Ҫԭ��____________________________________��
����������[Cr(H2O)3(NH3)3]3+�У��������ӵ���λ��Ϊ_______��NH3��VSEPRģ��Ϊ_______��
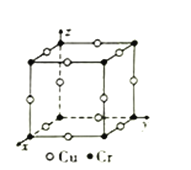
��ͼΪCu-Cr�γɵ�һ�ֺϽ�ľ���(���辧����ԭ��֮��˴�����)���������ڸþ�����Cuԭ�ӹ�����������ԭ������ɷֱ��ʾΪ����![]() ��0��0����(0��
��0��0����(0�� ![]() ��0)��_______����֪������Cr��Cuԭ�Ӽ���������Ϊ
��0)��_______����֪������Cr��Cuԭ�Ӽ���������Ϊ![]() apm,��þ�����ܶ�Ϊ_______g��cm-3(�ú�a�Ĵ���ʽ��ʾ����NAΪ�����ӵ�������ֵ)��
apm,��þ�����ܶ�Ϊ_______g��cm-3(�ú�a�Ĵ���ʽ��ʾ����NAΪ�����ӵ�������ֵ)��
���𰸡� 3 Mg2+�뾶��Cu2+�뾶С��MgO�ľ����ܱ�CuO�ߣ����MgO���۵�� 1��1 ![]() 3d54s1 sp3��sp2 �����γɵľ����Ϊ���Ӿ��壬���Ҵ����Ӽ����γ���������ã�ʹ���Ӽ�����������������ۡ��е�ȱ���� 6 �������� ��0��0��
3d54s1 sp3��sp2 �����γɵľ����Ϊ���Ӿ��壬���Ҵ����Ӽ����γ���������ã�ʹ���Ӽ�����������������ۡ��е�ȱ���� 6 �������� ��0��0�� ![]() ��
�� ![]() ��1030
��1030
��������(1)ͬһ���ڣ������ң�Ԫ�صĵ�һ�����ܳ��������ƣ�����IIA�塢��VA��Ԫ�صĵ�һ�����ܴ�������Ԫ�����ڵڶ����ڵ�Ԫ���У���һ�����ܽ���B��N֮���Ԫ����Be��C��O����3��Ԫ�أ��ʴ�Ϊ��3��
(2)Mg2+�뾶��Cu2+�뾶С��MgO�ľ����ܱ�CuO�ߣ����MgO���۵�ߣ��ʴ�Ϊ��Mg2+�뾶��Cu2+�뾶С��MgO�ľ����ܱ�CuO�ߣ����MgO���۵����
(3)Fe(CO)5�����д���5����λ����5��C��O������������������Ϊ(5+5) ��5��2=1:1����CO��Ϊ�ȵ����������Ϊ![]() ���ʴ�Ϊ��1��1��
���ʴ�Ϊ��1��1�� ![]() ��
��
(4)��CrΪ24��Ԫ�أ���̬��ԭ�ӵļ۲�����Ų�ʽΪ3d54s1��CH3COOH��������2��̼ԭ�ӣ����м��е�̼ԭ�Ӳ�ȡsp3�ӻ����Ȼ��е�̼ԭ�Ӳ�ȡsp2�ӻ����Ҵ��ͱ�����Է���������������Ҵ����ۡ��е�ȱ���ߺܶ࣬����Ϊ�Ҵ����Ӽ����γ�������ʴ�Ϊ��3d54s1��sp3��sp2�������γɵľ����Ϊ���Ӿ��壬���Ҵ����Ӽ����γ���������ã�ʹ���Ӽ���������������ۡ��е�ȱ������
��������[Cr(H2O)3(NH3)3]3+���������ӵ���λ��Ϊ3+3=6��NH3�е�Nԭ�ӵļ۲���Ӷ���=3+![]() (5-1��3)=4��VSEPRģ��Ϊ�������Σ��ʴ�Ϊ��6������������
(5-1��3)=4��VSEPRģ��Ϊ�������Σ��ʴ�Ϊ��6������������
�۸���Cu-Cr�γɵĺϽ�ľ������������ڸþ�����Cuԭ�ӹ�����������ԭ������ɷֱ��ʾΪ��(![]() ��0��0)��(0��
��0��0)��(0�� ![]() ��0)���ֱ���x���y���ϣ������������z���ϣ�����Ϊ(0��0��
��0)���ֱ���x���y���ϣ������������z���ϣ�����Ϊ(0��0�� ![]() )����֪������Cr��Cuԭ�Ӽ���������Ϊ
)����֪������Cr��Cuԭ�Ӽ���������Ϊ![]() apm�����ı߳�Ϊ
apm�����ı߳�Ϊ![]() apm�������к���Crԭ����=8��
apm�������к���Crԭ����=8��![]() =1��Cuԭ����=12��
=1��Cuԭ����=12��![]() =3������������=
=3������������=![]() g=
g=g�����������Ϊ(
![]() apm)3=(
apm)3=(![]() a��10-10)3 cm3����þ�����ܶ�Ϊ
a��10-10)3 cm3����þ�����ܶ�Ϊ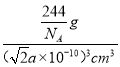 =
=![]() ��1030 g��cm-3���ʴ�Ϊ��(0��0��
��1030 g��cm-3���ʴ�Ϊ��(0��0�� ![]() )��
)�� ![]() ��1030��
��1030��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50 mL NaOH��Һ����ͨ��һ������CO2(������Һ�������)�����ȡ����Һ10 mL������ϡ����100 mL�������ϡ�ͺ����Һ����μ���0.1 mol��L-1���ᣬ����CO2��������(��״����)������������������ϵ����ͼ��ʾ��

(1) д��OA����������Ӧ�����ӷ���ʽ��______________��
(2)NaOH������CO2��������Һ������Ϊ____�������ʵ���Ũ��֮��Ϊ____��
(3)����CO2�����(��״����)Ϊ____��
(4)ԭNaOH��Һ�����ʵ���Ũ��Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳ���(CO��H2)��Ŀǰ�������õ�ԭ�ϣ��������ü����Ʊ��ϳ��������ַ�����
�� CH4(g)+H2O(g)![]() CO(g)+3H2(g) ��H1=+216 kJ��mol-1��
CO(g)+3H2(g) ��H1=+216 kJ��mol-1��
�� 2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g) ��H2=-72 kJ��mol-1��
2CO(g)+4H2(g) ��H2=-72 kJ��mol-1��
����һ����Ӧ�ķ�Ӧ�����������仯��ϵ��ͼ��ʾ��������˵����ȷ������ ��

A. E1��ʾ2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g)�Ļ��
2CO(g)+4H2(g)�Ļ��
B. E2��ʾCH4(g)+H2O(g)![]() CO(g)+3H2(g)�Ļ��
CO(g)+3H2(g)�Ļ��
C. ��ͼʾΪ��Ӧ���ķ�Ӧ�����������仯ʾ��ͼ
D. һ������£�������������ܽ���E1��Ҳ�ܽ���E2�������ܸı�E1��E2�IJ�ֵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Ϊ��Ԫ���ᣬ��25��ʱ��������������볣��Ϊ��Ka1=5.0��10-2,Ka2=m��ʵ�����ڸ��¶��¸ı�0.1mol��L-1��H2C2O4��Һ��pHֵʱ����Һ����Ҫ�������ʵ���������(X)��pHֵ�ı仯��ͼ��ʾ[��֪������(H2C2O4)=  ��1g5=0.7;��ͼ��b���Ӧ��pHֵΪ2.7]��������˵������ȷ������ ��
��1g5=0.7;��ͼ��b���Ӧ��pHֵΪ2.7]��������˵������ȷ������ ��
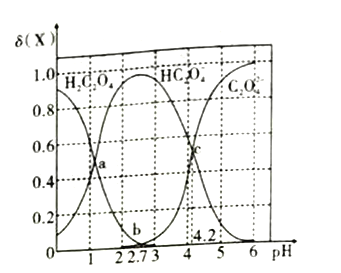
A. ��a�㣬��Һ��Ӧ��pHֵΪ1.3 B. pH=2.8ʱ��c(HC2O4-)>c(C2O42-)+c(H2C2O4)
C. pH=4.2ʱ��c(HC2O4-)=c(C2O42-)=c(H+) D. lgKa2=-4.2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�ʮ�Ŵ�ָ�����ӿ�ˮ��Ⱦ���Ρ�ʵʩ�����ͽ��������ۺ�������������Ⱦ�������ǻ�ѧ�������о�����Ҫ���⣬Ҳ�Ǽ�������ˮ��ɽ���ǽ�ɽ��ɽ������Ҫ�ٴ롣��ش��������⣺
��ѧ�о���������ǰӦ����㷺�Ļ�ʯȼ�ϵ���������Ҷ���ݽߣ������Σ������Ч;��֮һ����ʵ��ȼ�Ϻ�ȼ�ղ���֮�������ѭ��(��ͼ����ʾ)��
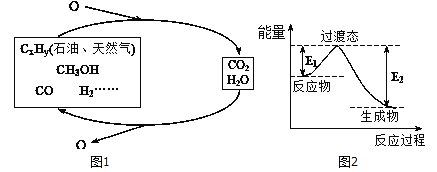
��1��һ�ֳ��õķ�������230�����д��������½�CO2��H2��ת��Ϊ�״�������ˮ������ͼ��������1molCH3OHʱ�������仯ʾ��ͼ����֪�ƻ�1mol��ͬ���ۼ�������(kJ) �ֱ����±���
C-H | C-O | C=O | H-H | H-O |
413.4 | 351 | 745 | 436 | 462.8 |
������ϱ����ݣ���д������CH3OH���Ȼ�ѧ��Ӧ����ʽ��____________________��
����֪E2=189.8kJ��mol-1����E1=_______��
��2������ͬ����CO(g) ��H2O(g) �ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������н������·�Ӧ�� CO(g)+H2O(g)![]() CO2(g)+H2(g) �õ����±���ʾ�������ݣ�
CO2(g)+H2(g) �õ����±���ʾ�������ݣ�
ʵ�� | �¶�/�� | ��ʼ�� | �ﵽƽ�� | |||
CO/mol | H2O/mol | H2/mol | COת���� | ����ʱ��/min | ||
1 | 650 | 4 | 2 | 1.6 | 6 | |
2 | 900 | 3 | 2 |
| 3 | |
3 | 900 | |||||
���÷�Ӧ����H_______0 (����<������>��)��
��ʵ��2�����µ�ƽ�ⳣ��K=_______��
��ʵ��3�У�����ʼʱ�������м���CO��H2O��CO2��H 2��1mol�����ʱv��_______v�� (����<����>������=��)��
��3���ϳɼ״�ʱ�����CO2 ��������Na2CO3��Һ�ӹ�ҵ����(��Ҫ��CO2) �в�����ԭ����ͼ��
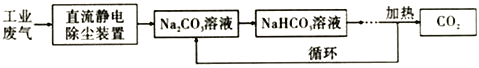
����100mL 0.1mol/L Na2CO3��Һ��ͨ��112mL (�ѻ���Ϊ��״��) CO2��������Һ��û�о����������Իش��������⣺
���ù�ҵ�����������������������װ����������______________________________��ԭ����
�������ӷ���ʽ����Na2CO3��Һ�ʼ��Ե�ԭ��_____________________��
����Ӧ��������Һ�еĸ�����Ũ���ɴ�С��˳����______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����и������ʣ�
A.���ʯ��ʯī��B.��������ά�أ�C.���뮣�D.���������飻E.�����������
F.  G.
G. 
���л�Ϊͬλ�ص���____________�����ţ���ͬ������Ϊͬϵ�����_______����Ϊͬ���칹�����__________����ͬһ�����ʵ���_____________��
��2��������A�Ľṹ��ʽΪ�� ����������ȼ��Ʒ�ʿ������ܵIJ��������A��ͬ���칹���к���ԭ���������ٵ�һ�ֽṹ��ʽΪ��__________����A����ϩ����H2ͨ���ӳɷ�Ӧ�õ���д����ϩ�������п��ܵĽṹ��ʽ__________��
����������ȼ��Ʒ�ʿ������ܵIJ��������A��ͬ���칹���к���ԭ���������ٵ�һ�ֽṹ��ʽΪ��__________����A����ϩ����H2ͨ���ӳɷ�Ӧ�õ���д����ϩ�������п��ܵĽṹ��ʽ__________��
��3��������ӵļ���ʽ��ͼ��ʾ���Իش�
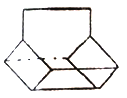
��д��������ӵĻ�ѧʽ____________��
��������ӵ�һ��ȡ���������Ϊ_______�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£�CO2(g)+3H2(g)![]() CH3OH (g)+H2O(g) ��H=��57.3 kJ/mol���� 2L �����ܱ������г��� 1 mol CO2��3 mol H2���ڲ�ͬ���������·�����Ӧ�١���Ӧ���뷴Ӧ�ۣ���ͬʱ����CO2��ת�������¶ȱ仯����ͼ��ʾ��b�㷴Ӧ�ﵽƽ��״̬������˵����ȷ����
CH3OH (g)+H2O(g) ��H=��57.3 kJ/mol���� 2L �����ܱ������г��� 1 mol CO2��3 mol H2���ڲ�ͬ���������·�����Ӧ�١���Ӧ���뷴Ӧ�ۣ���ͬʱ����CO2��ת�������¶ȱ仯����ͼ��ʾ��b�㷴Ӧ�ﵽƽ��״̬������˵����ȷ����
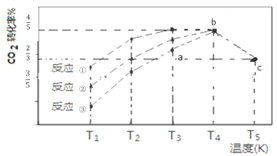
A. a �� v(��)>v(�棩
B. b�㷴Ӧ����53.7 kJ
C. ����Ч����ѵķ�Ӧ�Ǣ�
D. c��ʱ�÷�Ӧ��ƽ�ⳣ��K=4/3(mol-2![]() L-2)
L-2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ����ѡ���װ�û��������г�װ������ȥ����ȷ����
ѡ�� | A | B | C | D |
ʵ�� | ��CCl4��ȡ��ˮ�е�Br2 | ʯ�͵ķ��� | ��KI��I2�Ĺ��������л���I2 | ����100mL0.1000 mol��L-1 KCl��Һ |
װ�û����� |
|
|
|
|
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��5���л���ѧ����]ʯ���ѽ�����;�㷺�������ںϳɸ�����ҽҩ�м��塣����ʯ���ѽ����ϳ�CR��ҽҩ�м���K����·���£�
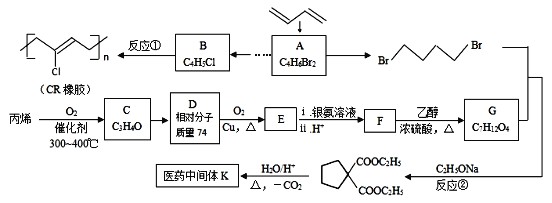
��֪��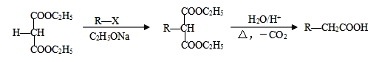
��1��A�ķ�ʽ�칹��Ľṹ��ʽΪ_________________��
��2����ϵͳ��������B��������������_________________��
��3��C��D��E��Ϊ��״�ṹ���Ҿ���������������ͭ����Һ��������ש��ɫ��������C�в������Ĺ�����������_________________�� д����ӦD��E�Ļ�ѧ����ʽ_________________��
��4��K�Ľṹ��ʽΪ_________________��
��5��д��F���Ҷ��������ۺϷ�Ӧ�Ļ�ѧ����ʽ______________________________��
��6��д��ͬʱ��������������ҽҩ�м���K������ͬ���칹��Ľṹ��ʽ___________��
a����E��Ϊͬϵ�� b���˴Ź���������3�ַ�
��7����֪˫���ϵ���ԭ�Ӻ��ѷ���ȡ����Ӧ����AΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�B��д���ϳ�·�ߣ�______________________________________________________________���ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com