
【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。请回答下列问题:
科学研究表明,当前应用最广泛的化石燃料到本世纪中叶将枯竭,解决此危机的有效途径之一便是实现燃料和燃烧产物之间的良性循环(如图甲所示):
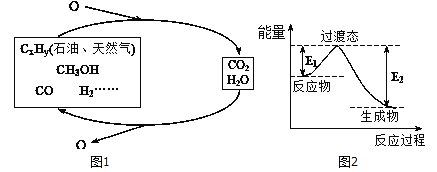
(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2,转化为甲醇蒸汽和水蒸气。图乙是生成1molCH3OH时的能量变化示意图。已知破坏1mol不同共价键的能量(kJ) 分别如下表:
C-H | C-O | C=O | H-H | H-O |
413.4 | 351 | 745 | 436 | 462.8 |
①结合上表数据,试写出生成CH3OH的热化学反应方程式:____________________。
②已知E2=189.8kJ·mol-1,则E1=_______。
(2)将不同量的CO(g) 和H2O(g) 分别通入到体积为2L的恒容密闭容器中进行如下反应: CO(g)+H2O(g)![]() CO2(g)+H2(g) 得到如下表所示三组数据:
CO2(g)+H2(g) 得到如下表所示三组数据:
实验 | 温度/℃ | 起始量 | 达到平衡 | |||
CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
1 | 650 | 4 | 2 | 1.6 | 6 | |
2 | 900 | 3 | 2 |
| 3 | |
3 | 900 | |||||
①该反应的△H_______0 (填“<”或“>”)。
②实验2条件下的平衡常数K=_______。
③实验3中,若起始时在容器中加入CO、H2O、CO2、H 2各1mol,则此时v正_______v逆 (填“<”“>”或“=”)。
(3)合成甲醇时所需的CO2 可以利用Na2CO3溶液从工业废气(主要含CO2) 中捕捉,其原理如图:
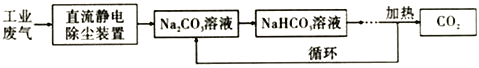
现向100mL 0.1mol/L Na2CO3溶液中通入112mL (已换算为标准状况) CO2,假设溶液中没有晶体析出,试回答下列问题:
①该工业废气处理过程中“静电除尘装置”利用了______________________________的原理。
②用离子方程式解释Na2CO3溶液呈碱性的原因:_____________________。
③反应后所得溶液中的各离子浓度由大到小的顺序是______________________________。
【答案】 CO2(g)+3H2(g)=CH3OH(g)+H2O△H=-181.6kJ/mol 8.2kJ/mol < ![]() < 胶体离子带电性(或胶体的电泳现象) CO32-+H2O
< 胶体离子带电性(或胶体的电泳现象) CO32-+H2O![]() HCO3-+OH- c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
HCO3-+OH- c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
【解析】(1)①反应热等于反应物总键能减去生成物的总键能,而二氧化碳与氢气反应生成甲醇的反应方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),可知该反应的反应热△H=(2×745+3×436-2×462.8-3×413.4-351-462.8)kJmol-1=-181.6kJmol-1,故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O△H=-181.6kJ/mol;
②由图可知:△H=E1-E2,所以E1=E2+△H=189.8kJ·mol-1-181.6kJmol-1=8.2kJmol-1,故答案为:8.2kJ/mol;
(2)①650℃根据方程式可知
CO(g)+H2O(g)CO2(g)+H2(g)
起始量(mol) 4 2 0 0
转化量(mol)1.6 1.6 1.6 1.6
平衡量(mol)2.4 0.4 1.6 1.6
因为两的计量数相等,所以反应前后体积不变,可以用物质的量代替浓度计算平衡常数,则该反应的平衡常数为K=![]() =
=![]() ;
;
900℃根据方程式可知
CO(g)+H2O(g)CO2(g)+H2(g)
起始量(mol)3 2 0 0
转化量(mol)1 11 1
平衡量(mol)21 1 1
此时平衡常数K=![]() =
=![]() ,而
,而![]() >
>![]() ,这说明升高温度平衡常数减小,因此升高温度平衡向逆反应方向进行,即正反应是放热反应,则该反应的△H<0,故答案为:<;
,这说明升高温度平衡常数减小,因此升高温度平衡向逆反应方向进行,即正反应是放热反应,则该反应的△H<0,故答案为:<;
②根据①的分析可知实验2条件下的平衡常数K=![]() ,故答案为:
,故答案为: ![]() ;
;
③实验3中,此时Qc=![]() =1>K,反应逆向进行,此时v正<v逆,故答案为:<;
=1>K,反应逆向进行,此时v正<v逆,故答案为:<;
(3)①胶体离子带有电性,在电场中能够定向移动,故答案为:胶体离子带电性(或胶体的电泳现象);
②Na2CO3溶液水解生成氢氧化钠,溶液呈碱性,离子方程式为CO32-+H2O![]() HCO3-+OH-,故答案为:CO32-+H2O
HCO3-+OH-,故答案为:CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
(3)①将100mL0.1mol/LNa2CO3的溶液溶质的物质的量为:0.1L×0.1mol/L=0.01mol,112mLCO2的物质的量为:0.005mol,发生反应Na2CO3+CO2+H2O=2NaHCO3,二者反应碳酸钠过量为0.005mol,同时生成0.01mol的NaHCO3,碳酸根离子的水解程度大于碳酸氢根离子,所以离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。


科目:高中化学 来源: 题型:
【题目】资料表明:赤热铜能与NO2反应。某小组设计了如下实验装置进行探究,探究固体产物的成分,气体产物是N2还是NO。
已知:酸性KMnO4溶液能氧化NO生成NO3ˉ;
NO和FeSO4溶液反应:NO+FeSO4=[Fe(NO)]SO4(棕色);
Cu2O+2H+=Cu+Cu2++H2O
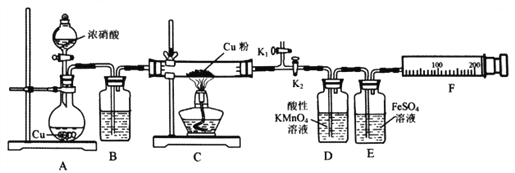
请回答下列问题:
(1)A中反应的化学方程式为________________________。
(2)检查装置气密性,装好药品,然后实验的正确操作顺序是____________
①关闭K1,打开K2 ②打开分液漏斗活塞
③打开K1,关闭K2 ④点燃C处酒精灯
(3)实验过程中,D装置中的现象是____________,能否根据D装置中的现象确认C中有无NO生成? ______,理由是________________________。
(4)E装置的作用是____________。
(5)当铜粉完全反应后,实验小组对反应后的固体成分提出以下猜想:①只有CuO;②只有Cu2O;有同学认为可通过简单的定性实验即可判断猜想①是否成立,其实验方法是_____________________。
(6)实验中E装置自始至终未显棕色,小组最后通过定量实验得到如下数据。
C装置质量 | F装置气体的体积(已折算为标准状况) | ||
玻管质量 | Cu质量 | 反应后(玻管+生成物) | |
mg | 1.92g | (m+2.24)g | 112mL |
据此写出实验时实际发生反应的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓盐酸中H3AsO3与SnCl2反应:SnCl2+H3AsO3+HCl(浓)→As+SnCl4+M,则正确的组合是( )
①H3AsO3被还原;②还原性:Cl->As;③M为电解质;④SnCl4是氧化产物;⑤每生成7.5gAs,还原剂失去的电子为0.3mol
A. ①③④⑤ B. ①④⑤ C. ①②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用NaHCO3和KHCO3组成的固体混合物进行实验,测得实验数据(盐酸的物质的量浓度相等)如表所示,下列说法不正确的是 ( )
盐酸/mL | 50 | 50 | 50 |
固体混合物质量/g | 9.2 | 15.7 | 27.6 |
标准状况下CO2体积/L | 2.24 | 3.36 | 3.36 |
A. 盐酸的物质的量浓度为3.0 mol·L-1 B. 根据表中数据能计算出混合物中NaHCO3的质量分数
C. 加入9.2g固体混合物时盐酸过量 D. 15.7g固体混合物恰好与盐酸完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373 K时,把0.5 mol N2O4通入体积为5 L的恒容真空密闭容器中,立即出现红棕色气体。反应进行到2 s时,NO2的浓度为0.02 mol·L-1。在60 s时,体系达到平衡状态,此时容器内的压强为开始时的1.6倍。下列说法错误的是( )
A. 前2 s以N2O4的浓度变化表示的平均反应速率为0.005 mol·L-1·s-1
B. 在2 s时体系内的压强为开始时的1.1倍
C. 平衡时体系内含N2O4 0.2 mol
D. 平衡时,N2O4的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氧、氮、镁、铬、铁、铜是几种重要的元素,请回答下列问题:
(1)在第二周期的元素中,第一电离能介于B与N之间的元素有_________种。
(2)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是____________________。
(3)Fe与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ键与π键个数比为______________。请写出一个与CO互为等电子体的离子:____________________。
(4)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Cr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+。
①K2Cr2O7具有很强的氧化性,能直接将CH3CH2OH氧化成CH3COOH,试写出基态铬原子的价层电子排布式:_______________;CH3COOH分子中碳原子的杂化类型为_________________;乙醇和丙烷相对分子质量相近,但乙醇的熔、沸点比丙烷高很多,试解释其主要原因:____________________________________。
②该配离子[Cr(H2O)3(NH3)3]3+中,中心离子的配位数为_______,NH3的VSEPR模型为_______。
③图为Cu-Cr形成的一种合金的晶胞(假设晶体中原子之间彼此相切),单独属于该晶胞的Cu原子共有三个,其原子坐标可分别表示为:(![]() ,0,0)、(0,
,0,0)、(0, ![]() ,0)、_______;已知晶胞中Cr和Cu原子间的最近距离为
,0)、_______;已知晶胞中Cr和Cu原子间的最近距离为![]() apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
apm,则该晶体的密度为_______g·cm-3(用含a的代数式表示,设NA为阿伏加德罗常数的值)。
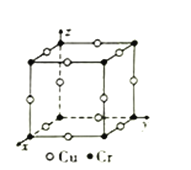
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列计算:
(1)某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8。若配制该营养液,取428gNH4Cl,则需KCl的质量为________g。
(2)在K2SO4和Al2(SO4)3的混合溶液中,测得Al3+的浓度为0.2molL﹣1,加入等体积0.6molL﹣1的BaCl2溶液恰好使SO42-完全沉淀,则混合溶液中K+的浓度为_____molL﹣1。
(3)某固态化合物X受热分解的反应为:X=A↑+B↑+C↑,在一定的温度和压强下测得反应生成的混合气体对氢气的相对密度为15,则X的摩尔质量是___________。
(4)标准状况下,将V L A气体(摩尔质量为M molL﹣1)溶于0.1L水(密度1g/cm3)中,所得溶液的密度为dg/mL,则此溶液的物质的量浓度为____________molL﹣1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中的一些常见物质有下图转化关系(部分产物未给出)。其中A的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属。

回答下列问题。
(1)F的电子式为 。
(2)G的化学式为 。
(3)写出反应①的化学方程式 。
(4)写出反应②的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com