
����Ŀ��ijͬѧ��NaHCO3��KHCO3��ɵĹ����������ʵ�飬���ʵ�����ݣ���������ʵ���Ũ����ȣ������ʾ������˵������ȷ���� ( )
����/mL | 50 | 50 | 50 |
������������/g | 9.2 | 15.7 | 27.6 |
��״����CO2���/L | 2.24 | 3.36 | 3.36 |
A. ��������ʵ���Ũ��Ϊ3.0 mol��L-1 B. ���ݱ��������ܼ�����������NaHCO3����������
C. ����9.2g��������ʱ������� D. 15.7g��������ǡ����������ȫ��Ӧ
���𰸡�D
��������
�������һ���������Ϊ15.7g��27.6gʱ���ɶ�����̼�����ȣ��ʻ����Ϊ27.6gʱ������ȫ��Ӧ�������15.7gʱ���ɶ�����̼���������9.2g���ɵĶ�����̼���ʻ����Ϊ9.2ʱ��������ʣ����
A.�ɱ������ݿ�֪����������Ũ��ʱ��ѡ��������������ݣ������Ź��������������ӣ�������״���¶�����̼���������������ӣ����������ѷ�Ӧ��ȫ��H����HCO===H2O��CO2����c(HCl)��![]() ��3.0 mol/L����A��ȷ��
��3.0 mol/L����A��ȷ��
B.���ݱ��е�һ�����ݹ����������������������״���µĶ�����̼�����������Լ����NaHCO3��������������B��ȷ��
C.���ڹ��������������9.2 g���ӵ�15.7 g��������״���¶�����̼��������Ҳ�����ӣ��ʼ���9.2 g��������ʱ�����������C��ȷ��
D.���ݹ�������������ı�����ϵ��֪��������״����3.36 L������̼�����������Ϊ![]() ��
��![]() �����m��13.8 g����ʱ����ǡ����ȫ��Ӧ����D������
�����m��13.8 g����ʱ����ǡ����ȫ��Ӧ����D������
��ѡD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ������ʾ��װ���У��ձ���ʢ�ŵ���Ba(OH)2��Һ�����ӵζ���������ij����ҺAʱ����Һ�ĵ����Եı仯������ͼ������ʾ��


(1)�μ�Һ����ͼ������������͵�ʱ�����ݿ���Ϩ�𣬿��ܵ�ԭ����__________________��
(2)�Ը������ӷ�Ӧ���ص��������ҺA�к��е����ʿ����ǣ�����ţ�____________��
��HCl ��H2SO4 ��NaHSO4 ��NaHCO3
(3)��֪0.1 mol��L-1NaHSO4��Һ��c(H��)=0.1 mol��L-1����ش��������⣺
��д��NaHSO4��ˮ��Һ�еĵ��뷽��ʽ___________________________��
��NaHSO4����________������������������������������
����NaHSO4��Һ�У���μ���Ba(OH)2��Һ�����ԣ���д��������Ӧ�����ӷ���ʽ��____________��������������Һ�У������μ�Ba(OH)2��Һ����д���˲���Ӧ�����ӷ���ʽ��_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ܴ������棬��������Ӧ�Լ���ᷢ����ѧ�仯���ҷ�����Ӧ�����ӷ���ʽ��д��ȷ����( )
ѡ�� | ���飨ˮ��Һ�� | �����Լ� | ���ӷ���ʽ |
A | H+�� Na���� | Fe�� | Fe+H+=Fe3++H2�� |
B | Na����Cl���� | ������ | 2Na+2H2O=2Na��+2OH-+H2�� |
C | NH4+��H+��CH3COO- | ������ | 6H++Fe2O3=2Fe3++3H2O |
D | Ca2����OH-��Cl�� | ͨ�����CO2 | OH-+CO2= |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳ���(CO��H2)��Ŀǰ�������õ�ԭ�ϣ��������ü����Ʊ��ϳ��������ַ�����
�� CH4(g)+H2O(g)![]() CO(g)+3H2(g) ��H1=+216 kJ��mol-1��
CO(g)+3H2(g) ��H1=+216 kJ��mol-1��
�� 2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g) ��H2=-72 kJ��mol-1��
2CO(g)+4H2(g) ��H2=-72 kJ��mol-1��
����һ����Ӧ�ķ�Ӧ�����������仯��ϵ��ͼ��ʾ��������˵����ȷ������ ��

A. E1��ʾ2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g)�Ļ��
2CO(g)+4H2(g)�Ļ��
B. E2��ʾCH4(g)+H2O(g)![]() CO(g)+3H2(g)�Ļ��
CO(g)+3H2(g)�Ļ��
C. ��ͼʾΪ��Ӧ���ķ�Ӧ�����������仯ʾ��ͼ
D. һ������£�������������ܽ���E1��Ҳ�ܽ���E2�������ܸı�E1��E2�IJ�ֵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��A(g) �� 2B(g) ![]() 2C(g) ��H= Q kJ��mol-1��Q��0�����ں��ݵ��ܱ������г���1 mol A��2 mol B��һ�������·�����Ӧ�������й�˵����ȷ���ǣ� ��
2C(g) ��H= Q kJ��mol-1��Q��0�����ں��ݵ��ܱ������г���1 mol A��2 mol B��һ�������·�����Ӧ�������й�˵����ȷ���ǣ� ��
A. ƽ��ǰ�����ŷ�Ӧ���У������������ܶ���С
B. ƽ��ʱ���÷�Ӧ�ų�������ΪQ kJ
C. ƽ�������������ͨ��1 mol������A��ת��������
D. ƽ�����С�����ݻ��ﵽ��ƽ�⣬A��Ũ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Ϊ��Ԫ���ᣬ��25��ʱ��������������볣��Ϊ��Ka1=5.0��10-2,Ka2=m��ʵ�����ڸ��¶��¸ı�0.1mol��L-1��H2C2O4��Һ��pHֵʱ����Һ����Ҫ�������ʵ���������(X)��pHֵ�ı仯��ͼ��ʾ[��֪������(H2C2O4)=  ��1g5=0.7;��ͼ��b���Ӧ��pHֵΪ2.7]��������˵������ȷ������ ��
��1g5=0.7;��ͼ��b���Ӧ��pHֵΪ2.7]��������˵������ȷ������ ��
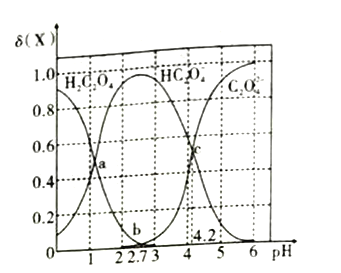
A. ��a�㣬��Һ��Ӧ��pHֵΪ1.3 B. pH=2.8ʱ��c(HC2O4-)>c(C2O42-)+c(H2C2O4)
C. pH=4.2ʱ��c(HC2O4-)=c(C2O42-)=c(H+) D. lgKa2=-4.2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�ʮ�Ŵ�ָ�����ӿ�ˮ��Ⱦ���Ρ�ʵʩ�����ͽ��������ۺ�������������Ⱦ�������ǻ�ѧ�������о�����Ҫ���⣬Ҳ�Ǽ�������ˮ��ɽ���ǽ�ɽ��ɽ������Ҫ�ٴ롣��ش��������⣺
��ѧ�о���������ǰӦ����㷺�Ļ�ʯȼ�ϵ���������Ҷ���ݽߣ������Σ������Ч;��֮һ����ʵ��ȼ�Ϻ�ȼ�ղ���֮�������ѭ��(��ͼ����ʾ)��
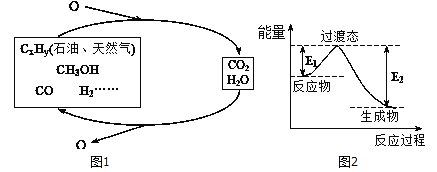
��1��һ�ֳ��õķ�������230�����д��������½�CO2��H2��ת��Ϊ�״�������ˮ������ͼ��������1molCH3OHʱ�������仯ʾ��ͼ����֪�ƻ�1mol��ͬ���ۼ�������(kJ) �ֱ����±���
C-H | C-O | C=O | H-H | H-O |
413.4 | 351 | 745 | 436 | 462.8 |
������ϱ����ݣ���д������CH3OH���Ȼ�ѧ��Ӧ����ʽ��____________________��
����֪E2=189.8kJ��mol-1����E1=_______��
��2������ͬ����CO(g) ��H2O(g) �ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������н������·�Ӧ�� CO(g)+H2O(g)![]() CO2(g)+H2(g) �õ����±���ʾ�������ݣ�
CO2(g)+H2(g) �õ����±���ʾ�������ݣ�
ʵ�� | �¶�/�� | ��ʼ�� | �ﵽƽ�� | |||
CO/mol | H2O/mol | H2/mol | COת���� | ����ʱ��/min | ||
1 | 650 | 4 | 2 | 1.6 | 6 | |
2 | 900 | 3 | 2 |
| 3 | |
3 | 900 | |||||
���÷�Ӧ����H_______0 (����<������>��)��
��ʵ��2�����µ�ƽ�ⳣ��K=_______��
��ʵ��3�У�����ʼʱ�������м���CO��H2O��CO2��H 2��1mol�����ʱv��_______v�� (����<����>������=��)��
��3���ϳɼ״�ʱ�����CO2 ��������Na2CO3��Һ�ӹ�ҵ����(��Ҫ��CO2) �в�����ԭ����ͼ��
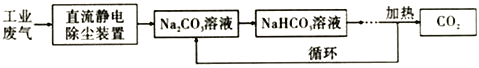
����100mL 0.1mol/L Na2CO3��Һ��ͨ��112mL (�ѻ���Ϊ��״��) CO2��������Һ��û�о����������Իش��������⣺
���ù�ҵ�����������������������װ����������______________________________��ԭ����
�������ӷ���ʽ����Na2CO3��Һ�ʼ��Ե�ԭ��_____________________��
����Ӧ��������Һ�еĸ�����Ũ���ɴ�С��˳����______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£�CO2(g)+3H2(g)![]() CH3OH (g)+H2O(g) ��H=��57.3 kJ/mol���� 2L �����ܱ������г��� 1 mol CO2��3 mol H2���ڲ�ͬ���������·�����Ӧ�١���Ӧ���뷴Ӧ�ۣ���ͬʱ����CO2��ת�������¶ȱ仯����ͼ��ʾ��b�㷴Ӧ�ﵽƽ��״̬������˵����ȷ����
CH3OH (g)+H2O(g) ��H=��57.3 kJ/mol���� 2L �����ܱ������г��� 1 mol CO2��3 mol H2���ڲ�ͬ���������·�����Ӧ�١���Ӧ���뷴Ӧ�ۣ���ͬʱ����CO2��ת�������¶ȱ仯����ͼ��ʾ��b�㷴Ӧ�ﵽƽ��״̬������˵����ȷ����
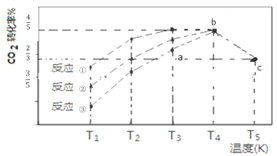
A. a �� v(��)>v(�棩
B. b�㷴Ӧ����53.7 kJ
C. ����Ч����ѵķ�Ӧ�Ǣ�
D. c��ʱ�÷�Ӧ��ƽ�ⳣ��K=4/3(mol-2![]() L-2)
L-2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������(H2SeO3)Ϊ��Ԫ���ᣬ�����£���ijŨ�ȵ���������Һ����μ���һ��Ũ�ȵ�NaOH��Һ��������Һ��H2SeO3��HSeO3-��SeO32-�����������ʵ�����������ҺpH �Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
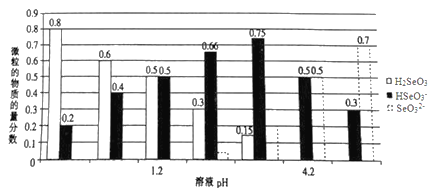
A. ����ͬ���ʵ���NaHSeO3��Na2SeO3 ������ȫ����ˮ�����pHΪ4.2�Ļ��Һ
B. pH=l.2����Һ�У�c(Na+)+c(H+)=c(OH-)+c(H2SeO3)
C. �����£�������ĵ���ƽ�ⳣ��K2=10-4.2
D. ��pH=1.2����Һ�еμ�NaOH��Һ��pH=4.2�Ĺ�����ˮ�ĵ���̶�һֱ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com