
【题目】在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)制取氯气时,在烧瓶中先加入一定量的二氧化锰固体,再通过__________(填写仪器名称)向烧瓶中加入适量的____________(填写试剂名称)。写出该反应的化学方程式并用双线桥法标出电子转移的方向和数目_________________________。
(2)为除去氯气中混有的杂质气体,可在①和②之间安装盛有__________(选填字母编号)的净化装置。
a. 碱石灰 b. 饱和食盐水 c. 浓硫酸 d. 饱和碳酸氢钠溶液
(3)③中发生反应的化学方程式______________________________________。比较制取氯酸钾和次氯酸钠的条件,可以初步得到的结论是:_____________________。
(4)反应完毕经冷却后,②的试管中有大量晶体析出,图中符合该晶体溶解度随温度变化规律的曲线是___________(选填字母);从②的试管中分离该晶体的操作是___________ (填写实验操作名称)。

(5)实验中可观察到④的试管中溶液颜色会发生变化:最初溶液由紫色变为 _______,随后溶液逐渐变为无色,是因为发生了反应______________(写化学方程式)。
(6)一定量的氢气在过量氯气中燃烧,所得的混合物用100mL 3.00mol/L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。所得溶液中Cl-的物质的量为______mol。
【答案】分液漏斗 浓盐酸 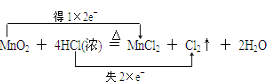 b Cl2+2NaOH=NaCl+NaClO+H2O 反应物的温度和浓度有可能会影响产物的类型 M 过滤 红色 Cl2+H2O
b Cl2+2NaOH=NaCl+NaClO+H2O 反应物的温度和浓度有可能会影响产物的类型 M 过滤 红色 Cl2+H2O![]() HCl+HClO 0.25
HCl+HClO 0.25
【解析】
该实验的目的是制取氯酸钾、次氯酸钠和探究氯水的性质,①是制取氯气的装置;②是制取氯酸钾装置;③是制取次氯酸钠装置;④是验证氯水的漂白性;⑤是氯气的尾气处理装置。
(1)实验室中制取氯气用的二氧化锰固体和浓盐酸,其中浓盐酸装在分液漏斗中进行滴加便于控制浓盐酸的加入量以此控制反应地进行,浓盐酸与二氧化锰在加热条件下发生反应生成氯气和氯化锰和水,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,反应中转移的电子数目为2NA,故答案为:分液漏斗;浓盐酸;
MnCl2+Cl2↑+2H2O,反应中转移的电子数目为2NA,故答案为:分液漏斗;浓盐酸;
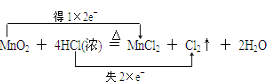 ;
;
(2)制取氯气时需要加热,浓盐酸易挥发,制取的氯气中含有氯化氢,氯化氢易溶于水,而氯气在饱和食盐水中溶解度不大,可以使用饱和食盐水,既除去HCl又降低氯气在水中的溶解度,即选用b,故答案为:b;
(3)③是制取次氯酸钠装置,反应原理为15 mL8%NaOH溶液在冰水浴中与氯气反应生成次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;制取氯酸钾和次氯酸钠的条件有两个不同点:制取温度不同,制取制取氯酸钾需要较高温度,制取次氯酸钠需要较低温度,制取时碱的浓度也不同,取氯酸钾需要浓度较大的碱,制取次氯酸钠需要浓度较小的碱,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;反应物的温度和浓度有可能会影响产物的类型;(4)因反应完毕后将试管②冷却会析出大量晶体,这说明析出的氯酸钾晶体的溶解度随温度的降低而降低,因此溶解度曲线M符合,从溶液中分离出固体的方法是过滤,故答案为:M;过滤;
(5)试管④中盛的是紫色石蕊试液,因将氯气通入后会发生如下反应Cl2+H2O![]() HCl+HClO,而生成的HCl和HClO均为一元酸使溶液显酸性,所以溶液由紫色变为红色,同时由于生成的HClO具有强氧化性,能将有机色质氧化为无色物质,因此变红的溶液由逐渐退为无色;当溶液中的有机色质――石蕊消耗没时,在继续通入氯气,将会使溶液达到饱和而成为饱和氯水,此时溶液的颜色为浅黄绿色,故答案为:红色;Cl2+H2O
HCl+HClO,而生成的HCl和HClO均为一元酸使溶液显酸性,所以溶液由紫色变为红色,同时由于生成的HClO具有强氧化性,能将有机色质氧化为无色物质,因此变红的溶液由逐渐退为无色;当溶液中的有机色质――石蕊消耗没时,在继续通入氯气,将会使溶液达到饱和而成为饱和氯水,此时溶液的颜色为浅黄绿色,故答案为:红色;Cl2+H2O![]() HCl+HClO;
HCl+HClO;
(6)所得溶液中为NaCl和NaClO的混合物,根据电荷守恒可知n(Na+)=n(Cl-)+n(ClO-),
则n(Cl-)=n(Na+)-n(ClO-)=0.3mol-0.05mol=0.25mol,故答案为:0.25。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Cu、Fe、Se、Co、S、P等元素常用于化工材料的合成。请回答下列问题:
(1)Fe3+最外层电子排布式为___________,其核外共有_____种不同运动状态的电子。Fe3+比Fe2+更稳定的原因是_______________________________________。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为_________________(用元素符号表示),SeO2分子的空间构型为___________________。
(3)P4S3可用于制造火柴,其分子结构如图所示。P4S3分子中硫原子的杂化轨道类型为__________,每个P4S3分子中含孤电子对的数目为_______________。

(4)铜的某种氧化物晶胞结构如图所示,若该晶胞的边长为a cm,则该氧化物的密度为________g·cm-3。(设阿伏加德罗常数的值为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃PMMA[结构简式为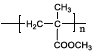 的一种合成路线如下:
的一种合成路线如下:
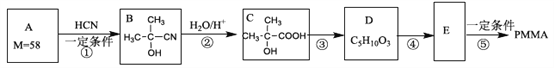
请按照要求回答下列问题:
(1)A属于酮类,其结构简式为________,反应①的类型是___________,E的分子式为_________。
(2)反应③的化学方程式_______________。
(3)检验E中官能团所需试剂及其对应的现象_______________。
(4)已知有机物F的结构简式为![]() 。
。
①以苯酚为主要原料,其他无机试剂根据需要选择,应用上述流程相关信息,设计合成F的路线:_______________。
②写出符合下列条件的F的所有同分异构体的结构简式_______________。
i.  的二取代物
的二取代物
ii. 能与NaHCO3溶液反应产生CO2
iii.核磁共振氢谱有4个吸收峰,且峰面积之比为6:2:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时纯水的电离度为a1,pH=2的醋酸溶液的电离度为a2,pH=12的氢氧化钠溶液中水的电离度为a3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a4。下列关系式中正确的是
A. a3=a2<a1<a4 B. a2=a3<a4<a1
C. a2<a3<a1<a4 D. a1<a2<a3<a4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)等质量的氧气和臭氧(O3),它们的物质的量之比为__________,所含分子数之比为__________,所含原子数之比为__________。
(2)中和含0.2molHCl的稀盐酸,需NaOH固体的质量为__________g。
(3)某气态氧化物的化学式为RO2,标准状况下1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为_____,R的相对原子质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
D.将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年12月19日,中国绿色碳汇基金会印发《关于授予江口县“碳汇城市”称号的决定》。我市江口县成为全国第三个、我省首个“碳汇城市”。碳汇,是指通过植树造林、森林管理、植被恢复等措施,利用植物光合作用吸收大气中的二氧化碳6CO2(g) +6H2O(l) === C6H12O6(s)+6O2(g) ,并将其固定在植被和土壤中,从而减少温室气体在大气中浓度的过程、活动或机制。已知每吸收1molCO2需要吸收能量约为470kJ.据此回答下列问题:
(1)碳汇过程中能量的转化形式由__________能转化为___________能;据相关资料表明,每1m3林木,大约能吸收能量为1.88×107kJ,大约可以吸收CO2______吨;葡萄糖燃烧的热化学方程式为:_____________ 。
(2)工业废气中的CO2可用碱液吸收。所发生的反应如下:
CO2(g)+2NaOH(aq)===Na2CO3(aq)+H2O(l) ΔH=-a kJ·mol-1
CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-b kJ·mol-1
则:①反应CO2(g)+H2O(l)+Na2CO3(aq)===2NaHCO3(aq)的ΔH=______ kJ·mol-1(用含a、b的代数式表示)。
(3)生产液晶显示器的过程中使用的化学清洗剂NF3和CO2一样是一种温室气体 ,在大气中的寿命可长达740年之久。以下是几种化学键的键能:
化学键 | N≡N | F—F | N—F |
键能/kJ·mol-1 | 941.7 | 154.8 | 283.0 |
①反应:N2(g)+3F2(g)=2NF3(g)ΔH=_________________
②下列说法中不正确的有_____________
A.过程:N2(g)![]() 2N放出能量
2N放出能量
B.过程:N+3F![]() NF3(g)放出能量
NF3(g)放出能量
C.使用催化剂能减小反应的ΔH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com