
【题目】25℃时纯水的电离度为a1,pH=2的醋酸溶液的电离度为a2,pH=12的氢氧化钠溶液中水的电离度为a3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a4。下列关系式中正确的是
A. a3=a2<a1<a4 B. a2=a3<a4<a1
C. a2<a3<a1<a4 D. a1<a2<a3<a4
【答案】B
【解析】在25℃时,纯水中H2O![]() H++OH-,Kw=c(H+)c(OH-)=10-14,所以水电离出的c(H+)=c(OH-)=1×10-7molL-1,纯水的电离度为a1;pH=2的醋酸中c(H+)=0.01mol/L,根据Kw=c(H+)c(OH-)=10-14可知溶液中c(OH-)=10-12mol/L,溶液中c(OH-)来自于水的电离,水电离出的c(H+)=c(OH-)=10-12mol/L,pH=2的醋酸中水的电离度为a2,a2<a1;pH=12的氢氧化钠溶液中c(H+)=10-12mol/L,溶液中c(H+)来自于水的电离,水电离出的c(H+)=c(OH-)=10-12mol/L,pH=12的氢氧化钠溶液中水的电离度为a3,a2=a3<a1;醋酸为弱电解质,pH=2的醋酸和pH=12的氢氧化钠按等体积混合,醋酸过量,所得溶液呈酸性,所以反应后所得溶液中水的电离度为a4<a1,综上所述a2=a3<a4<a1,答案选B。
H++OH-,Kw=c(H+)c(OH-)=10-14,所以水电离出的c(H+)=c(OH-)=1×10-7molL-1,纯水的电离度为a1;pH=2的醋酸中c(H+)=0.01mol/L,根据Kw=c(H+)c(OH-)=10-14可知溶液中c(OH-)=10-12mol/L,溶液中c(OH-)来自于水的电离,水电离出的c(H+)=c(OH-)=10-12mol/L,pH=2的醋酸中水的电离度为a2,a2<a1;pH=12的氢氧化钠溶液中c(H+)=10-12mol/L,溶液中c(H+)来自于水的电离,水电离出的c(H+)=c(OH-)=10-12mol/L,pH=12的氢氧化钠溶液中水的电离度为a3,a2=a3<a1;醋酸为弱电解质,pH=2的醋酸和pH=12的氢氧化钠按等体积混合,醋酸过量,所得溶液呈酸性,所以反应后所得溶液中水的电离度为a4<a1,综上所述a2=a3<a4<a1,答案选B。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 键能越大,表示该分子越容易受热分解
B. 共价键都具有方向性
C. 在分子中,两个成键的原子间的距离叫键长
D. H—Cl的键能为431.8 kJ·mol-1,H—Br的键能为366 kJ·mol-1,这可以说明HCl比HBr分子稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol·L-1NaOH溶液滴定新配制的25.0mL0.02 mol·L-1FeSO4溶液,应用手持技术测定溶液的pH与时间(t)的关系,结果如右图所示。下列说法错误的是
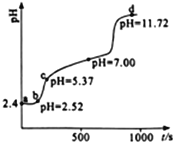
A. ab段,溶液中发生的主要反应:H++OH-=H2O
B. bc段,溶液中c(Fe2+) > (Fe3+) >c(H+)>c(OH-)
C. d点,溶液中的离子主要有Na+、SO42-、OH-
D. 滴定过程发生了复分解反应和氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检测明矾样晶(含砷酸盐)中的砷含量是否超标,实验装置如下图所示(夹持装置已略去)。
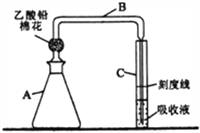
【实验1】配制砷标准溶液
①取0.132gAg2O3,用NaOH溶液完全溶解后,配制成1LNa3AsO3溶液(此溶液1mL相当于0.10mg砷);
②取一定量上述溶液,配制1L含砷量为1mg·L-1的砷标准溶液。
(1)步骤①中,必须使用的玻璃仪器除烧杯、玻璃棒外,还有__________。步骤②需取用步骤①中Na3AsO3溶液____mL。
【实验2】制备砷标准对照液
①往A瓶中加入2.00mL砷标准溶液,再依次加入一定量的盐酸、KI溶液和SnCl2溶液,混匀,室温放置10 min,使砷元素全部转化为H3AsO3。
②往A瓶中加入足量锌粒(含有ZnS杂质),立即塞上装有乙酸铅棉花的导气管B,并使B管右侧末端插入比色管C中银盐吸收液的液面下,控制反应温度25~40℃,45 min后,生成的砷化氢气体被完全吸收,Ag+被还原为红色胶态银。
③取出C管,向其中添加氯仿至刻度线,混匀,得到砷标准对照液。
(2)乙酸铅棉花的作用是_____________________。
(3)完成生成砷化氢反应的离子方程式:
____Zn+____H3AsO3+____H+=____( )+ ____Zn2++____( )________________
(4)控制A 瓶中反应温度的方法是________________________;反应中,A瓶有较多氢气产生,氢气除了搅拌作用外,还具有的作用是_____________________________。
(5)B管右侧末端导管口径不能过大(约为1mm),原因是__________________________。
【实验3】判断样品中砷含量是否超标
称取ag明矾样品替代【实验2】 ①中“2.00m砷标准溶液”,重复【实验2】后续操作。将实验所得液体与砷标准对照液比对,若所得液体的颜色浅,说明该样品含砷量未超标,反之则超标。
(6)国标规定砷限量为百万分之二(质量分数),则a的值为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
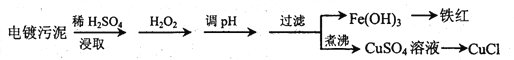
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是________________,调pH的最适宜范围为________________。
(2)调pH过程中加入的试剂最好是___________。
A. NaOH B. CuO C.NH3·H2O D.HCl
(3)煮沸CuSO4溶液的原因是_________。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式_________。
(4)过滤后的沉淀表面通常附着有一些杂质离子,为得到纯净产物,需要进行洗涤,确定沉淀洗涤干净的操作及现象是_________。
(5)称取所制备的CuCl样品0.2500g置于一定量的0.5mol·L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000 mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺最早被李比希于1834年合成,它有毒,不可用于食品加工或食品添加剂。经李比希法分析得知,三聚氰胺分子中,氮元素的含量高达66.67%,氢元素的质量分数为4.76%,其余为碳元素。它的相对分子质量大于100,但小于150。试回答下列问题:
(1)分子式中原子个数比N(C)∶N (H)∶N(N)=________________________。
(2)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳氮两种元素组成的六元杂环。则三聚氰胺的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1)基态氮原子最高能级上电子的自旋方向有________种,硒原子的电子排布式为[Ar]_____。
(2)铁的一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于________(填晶体类型)。
(3)与BF3互为等电子体的分子和离子分别为______(各举1例);已知分子中的大π键可用符号Ⅱnm表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Ⅱ66),则BF3中的大π键应表示为________。
(4)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为_______(填字母)。

(5)砷化硼(BAs)晶体结构与金刚石相似,则:
①BAs晶体中,As的杂化形式为_________.
②已知B原子的电负性比As原子的电负性大,则As与B之间存在的化学键有______(填字母)。
A.离子键 B.金属键 C.极性键 D.氢键 E.配位键 F.σ键 G.π键
③BAs晶体的晶胞参数为bpm,则其晶体的密度为______(列出表达式,设NA为阿伏加德罗常数的数值)g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①大气固氮;②硝酸银分解;③实验室制取氨气等变化中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
A.①②③B.②①③C.③②①D.③①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com