
【题目】常温下,用0.1mol·L-1NaOH溶液滴定新配制的25.0mL0.02 mol·L-1FeSO4溶液,应用手持技术测定溶液的pH与时间(t)的关系,结果如右图所示。下列说法错误的是
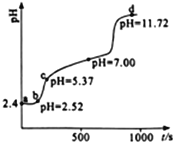
A. ab段,溶液中发生的主要反应:H++OH-=H2O
B. bc段,溶液中c(Fe2+) > (Fe3+) >c(H+)>c(OH-)
C. d点,溶液中的离子主要有Na+、SO42-、OH-
D. 滴定过程发生了复分解反应和氧化还原反应
【答案】B
【解析】A、ab段,新配制的25.0mL0.02 mol·L-1FeSO4溶液,为抑制水解加了些硫酸,溶液中发生的主要反应:H++OH-=H2O,故A正确;B. bc段,c(H+)> (Fe3+) ,故B错误;C.d点 pH =11.72,表示滴定反应已完全结束, 此时溶液含有硫酸钠与过量的氢氧化滴定反应已完全结束, 此时溶液含有硫酸钠与过量的氢氧化滴定反应已完全结束, 此时溶液含有硫酸钠与过量的氢氧化钠,溶液中的离子主要有 Na+、SO42-、OH-,C正确;D、 滴定过程中发生的反应有酸碱中和反应、硫酸亚铁与氢氧化钠的复分解反应、氢氧化亚铁与氧气的氧化还原反应,故D正确。


科目:高中化学 来源: 题型:
【题目】夹紧下列装置中的弹簧夹并进行相关操作。下列情形中,表明相应装置漏气的是( )
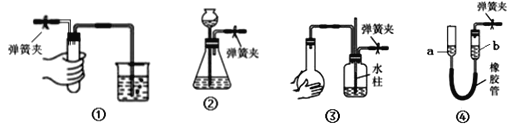
A. 装置①中,用手捂住试管,烧杯中出现气泡,放开手后,导管中形成一段稳定的水柱
B. 装置②中,向长颈漏斗中加入一定量水,形成水柱,随后水柱下降至与瓶中液面相平的位置
C. 装置③中,双手捂住烧瓶,导管中形成一段稳定的水柱,双手放开后,水柱慢慢回落
D. 装置④中,将a管向上提至一段高度,a、b两管之间水面形成稳定的高度差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:

(1)从开始至2min,X的平均反应速率为__________;
(2)该反应的化学方程式为_______________________;
(3)1min时,正逆反应速率的大小关系为:v(正)_____v(逆),2min时,v(正)_____v(逆)。(填“>”或“<”或“=”)
(4)若X、Y、Z均为气体,在2min时,向容器中通入氩气,增大体系压强,X的化学反应速率将______,若加入适合的催化剂,Y的化学反应速率将______。(填“变大”或“不变”或“变小”)
(5)若X、Y、Z均为气体,下列能说明反应已达平衡的是_____________。
a.X、Y、Z三种气体的浓度相等
b.气体混合物物质的量不再改变
c.反应已经停止
d.反应速率v(X)︰v(Y)=2:1
e.(单位时间内消耗X的物质的量):(单位时间内消耗Z的物质的量)=3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 2.0 mol·L-1 B. 1.5 mol·L-1 C. 0.18 mol·L-1 D. 0.24 mol·L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS) 是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣 (有效成分为Fe2O3和Fe3O4) 制备PFS,其工艺流程如下图所示。
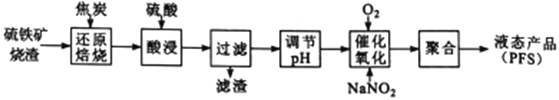
(1)“还原焙烧”过程中,CO还原Fe3O4生成FeO的热化学方程式为___________________________。
已知:Fe3O4(s)+C(s)=3FeO(s)+CO(g) ΔH1= 191.9kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
C(s)+CO2(g) =2CO(g) ΔH3= 172.5kJ·mol-1
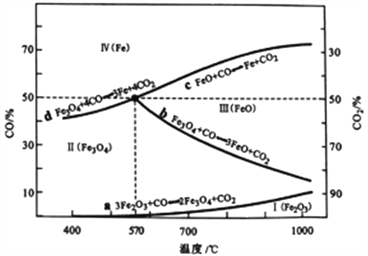
(2)CO是“还原焙烧" 过程的主要还原剂。下图中,曲线表示4个化学反应a、b、c、d达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域。a属于_________(填“吸热反应”或“放热反应”);570℃时,d反应的平衡常数K=_________________。
(3)工业上,“还原培烧”的温度一般控制在800℃左右,温度不宜过高的理由是____________________。
(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是___________________________。
(5)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17, Ksp[Fe(OH)3]=1.0×10-39,若浸出液中c(Fe2+) =10-1.8mol·L-1,为避免“催化氧化”过程中产生Fe(OH)3,应调节浸出液的pH≤_____________。
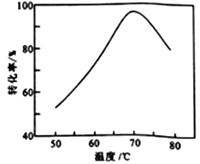
(6)FeSO4溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,该反应的离子方程式为_________________________。“催化氧化”过程用NaNO2作催化剂(NO起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+转化率随温度的升高先上升后下降的原因是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,欲测定Na2O2试样的纯度。可供选用的反应物只有CaCO3固体、6mol·L-1硫酸、6mol·L-1盐酸和蒸馏水。已知:①浓硫酸有吸水性、脱水性和强氧化性,②碱石灰的成分为CaO和NaOH。实验方案为:①制备并提纯CO2。②将纯净的CO2通过试样。③测定生成O2的体积。④根据O2的体积计算Na2O2试样的纯度。实验装置如下:

回答下列问题:
(1)装置A中发生反应的离子方程式是______________________________________。
(2)装置B的作用是_______________________,装置C的作用是_______。
(3)装置E的作用是__________________________________________
(4)装置D中发生反应的化学方程式是______________________________________。
(5)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时纯水的电离度为a1,pH=2的醋酸溶液的电离度为a2,pH=12的氢氧化钠溶液中水的电离度为a3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a4。下列关系式中正确的是
A. a3=a2<a1<a4 B. a2=a3<a4<a1
C. a2<a3<a1<a4 D. a1<a2<a3<a4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 1 mol/L NaCl溶液中含有的钠离子数为NA
B. 1molN2与4molH2在密闭容器中充分反应生成的NH3分子数为2NA
C. 将含0.1molFeCl3的饱和溶液滴入沸水形成的胶体粒子的数目小于0.1 NA
D. 10 g 46%的CH3CH2OH的水溶液中含氢原子数目为0.6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com