
【题目】某温度下,在一个1L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:

(1)从开始至2min,X的平均反应速率为__________;
(2)该反应的化学方程式为_______________________;
(3)1min时,正逆反应速率的大小关系为:v(正)_____v(逆),2min时,v(正)_____v(逆)。(填“>”或“<”或“=”)
(4)若X、Y、Z均为气体,在2min时,向容器中通入氩气,增大体系压强,X的化学反应速率将______,若加入适合的催化剂,Y的化学反应速率将______。(填“变大”或“不变”或“变小”)
(5)若X、Y、Z均为气体,下列能说明反应已达平衡的是_____________。
a.X、Y、Z三种气体的浓度相等
b.气体混合物物质的量不再改变
c.反应已经停止
d.反应速率v(X)︰v(Y)=2:1
e.(单位时间内消耗X的物质的量):(单位时间内消耗Z的物质的量)=3:2
【答案】0.15mol·L-1·min-1 3X + Y![]() 2Z > = 不变 变大 be
2Z > = 不变 变大 be
【解析】
(1)从开始至2min,X的物质的量减少了1mol-0.7mol=0.3mol,浓度是0.3mol/L,则平均反应速率为0.3mol/L÷2min=0.15mol·L-1·min-1;(2)从开始至2min,Y的物质的量减少了1mol-0.9mol=0.1mol,Z增加了0.2mol,则根据变化量之比是相应的化学计量数之比可知该反应的化学方程式为3X+Y![]() 2Z;(3)1min时反应没有达到平衡状态,反应向正反应方向进行,则正逆反应速率的大小关系为:v(正)>v(逆),2min时反应达到平衡状态,则v(正)=v(逆)。(4)若X、Y、Z均为气体,在2min时,向容器中通入氩气,增大体系压强,由于物质的浓度不变,则X的化学反应速率将不变,若加入适合的催化剂,Y的化学反应速率将变大。(5)a.X、Y、Z三种气体的浓度相等不能说明正逆反应速率相等,则不一定处于平衡状态,a错误;b.正反应体积减少,则气体混合物物质的量不再改变说明反应达到平衡状态,b正确;c.平衡时正逆反应速率相等,但不为0,反应没有停止,c错误;d.反应速率v(X)︰v(Y)=2:1说明正逆反应速率不相等,则没有处于平衡状态,d错误;e.(单位时间内消耗X的物质的量):(单位时间内消耗Z的物质的量)=3:2说明正逆反应速率相等,则一定处于平衡状态,e正确,答案选be。
2Z;(3)1min时反应没有达到平衡状态,反应向正反应方向进行,则正逆反应速率的大小关系为:v(正)>v(逆),2min时反应达到平衡状态,则v(正)=v(逆)。(4)若X、Y、Z均为气体,在2min时,向容器中通入氩气,增大体系压强,由于物质的浓度不变,则X的化学反应速率将不变,若加入适合的催化剂,Y的化学反应速率将变大。(5)a.X、Y、Z三种气体的浓度相等不能说明正逆反应速率相等,则不一定处于平衡状态,a错误;b.正反应体积减少,则气体混合物物质的量不再改变说明反应达到平衡状态,b正确;c.平衡时正逆反应速率相等,但不为0,反应没有停止,c错误;d.反应速率v(X)︰v(Y)=2:1说明正逆反应速率不相等,则没有处于平衡状态,d错误;e.(单位时间内消耗X的物质的量):(单位时间内消耗Z的物质的量)=3:2说明正逆反应速率相等,则一定处于平衡状态,e正确,答案选be。


科目:高中化学 来源: 题型:
【题目】某学习小组欲从工业废钒催化剂中回收V2O5,通过分析知该废钒催化剂的主要成分如下表:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~29 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
他们通过查阅资料找到一种废钒催化剂的回收工艺流程路线如下:
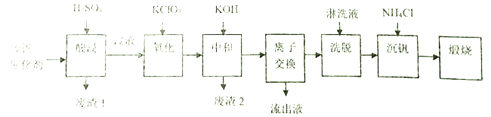
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则“废渣1”的主要成分是_____________。
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式________________________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有__________(用化学式表示)。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉定的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,请回答下列问题:
(1)已知氨气的相对分子质量为17,则氨气的摩尔质量为__________。
(2)已知一个铁原子的质量为bg,则铁原子的摩尔质量为____________。
(3)已知ag某气体中含分子数为b,则该气体的摩尔质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 键能越大,表示该分子越容易受热分解
B. 共价键都具有方向性
C. 在分子中,两个成键的原子间的距离叫键长
D. H—Cl的键能为431.8 kJ·mol-1,H—Br的键能为366 kJ·mol-1,这可以说明HCl比HBr分子稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小,性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。下列说法正确的是

A. 外电路的电流方向是由a极流向b极
B. 正极的电极反应式是MnO2+e+Li+===LiMnO2
C. 锂锰电池可以用KOH溶液作为电解质溶液
D. 放电过程中Li+离子从正极向负极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2D(g)△H=QkJ/mol。相关条件和数据见下表:
2D(g)△H=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验I | 实验II | 实验III |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 50 | 30 |
n(D)平衡/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是
A. 升高温度能加快反应速率的原理是降低了反应的活化能,使活化分子百分数提高
B. 实验III达平衡后,保持其他条件不变,再向容器中通入1molA和1molD,平衡不移动
C. 实验III达平衡后容器内的压强是实验1的9/10倍
D. K3>K2>K1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol·L-1NaOH溶液滴定新配制的25.0mL0.02 mol·L-1FeSO4溶液,应用手持技术测定溶液的pH与时间(t)的关系,结果如右图所示。下列说法错误的是
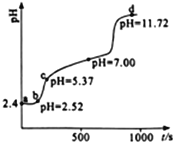
A. ab段,溶液中发生的主要反应:H++OH-=H2O
B. bc段,溶液中c(Fe2+) > (Fe3+) >c(H+)>c(OH-)
C. d点,溶液中的离子主要有Na+、SO42-、OH-
D. 滴定过程发生了复分解反应和氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺最早被李比希于1834年合成,它有毒,不可用于食品加工或食品添加剂。经李比希法分析得知,三聚氰胺分子中,氮元素的含量高达66.67%,氢元素的质量分数为4.76%,其余为碳元素。它的相对分子质量大于100,但小于150。试回答下列问题:
(1)分子式中原子个数比N(C)∶N (H)∶N(N)=________________________。
(2)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳氮两种元素组成的六元杂环。则三聚氰胺的结构简式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com