
【题目】某学习小组欲从工业废钒催化剂中回收V2O5,通过分析知该废钒催化剂的主要成分如下表:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~29 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
他们通过查阅资料找到一种废钒催化剂的回收工艺流程路线如下:
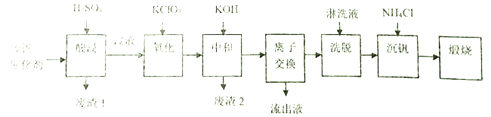
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则“废渣1”的主要成分是_____________。
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式________________________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有__________(用化学式表示)。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉定的化学方程式__________________。
【答案】 SiO2 6VO2++ClO3-+3H2O=6VO22++Cl-+6H+ Fe(OH]3和Al(OH)3 K+ 碱 4NH4Cl+K4V4O12=4NH4VO3+4KC1
【解析】(1)SiO2不溶于水、酸,通过过滤除去,在废渣中,V2O5被还原为VO2+,V2O4转成VO2-,与其他离子一起存在在滤液中;(2) “氧化”的目的是使VO2+变为VO22+,该反应的离子方程式为:6VO2++ClO3-+3H2O=6VO2++Cl-+6H+;(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,而溶液中Fe3+、Al3+与KOH反应生成Fe(OH)3、Al(OH)3形成“废渣2”而除去;(4) “离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是钾离子,由上述平衡移动分析可知,为了提高洗脱效率,淋洗液应该呈碱性;(5)生成偏钒酸铵(NH4VO3)沉淀的化学方程式为:4NH4Cl+K4V4O12=4NH4VO3↓+3KCl 。
R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是钾离子,由上述平衡移动分析可知,为了提高洗脱效率,淋洗液应该呈碱性;(5)生成偏钒酸铵(NH4VO3)沉淀的化学方程式为:4NH4Cl+K4V4O12=4NH4VO3↓+3KCl 。


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法不正确的是
A. 1mol过氧化钠与水完全反应,转移电子数为NA
B. 46g NO2与N2O4混合气体中含有原子数为3NA
C. 标准状况下,11.2LCCl4含有的分子数为0.5 NA
D. 含有0.1 NA个CO32-的Na2CO3固体的质量为10.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z 在周期表中的相对位置如图所示。已知: Y的最高价氧化物对应的水化物既能与强碱反应,又能与强酸反应。下列说法不正确的是
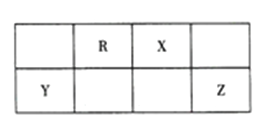
A. 简单气态氢化物的热稳定性: R<X
B. Y、Z的简单离子在同一溶液中能大量共存
C. 工业上,采用电解法冶炼单质Y
D. RZ2是含极性键的共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有机物的结构可用“键线式”简化表示.CH3-CH=CH-CH3可简写为![]() .有机物X的键线式为:
.有机物X的键线式为:
(1)有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式_______________;
(2)Y在一定条件下发生聚合反应,写出其反应的化学方程式_______________________;
(3)二甲苯苯环上的一溴代物有6种同分异构体,这些一溴代物与生成它们的对应二甲苯的熔点分别为:
一溴代二甲苯 | 234℃ | 206℃ | 213.8℃ | 204℃ | 214.5℃ | 205℃ |
对应二甲苯 | 13℃ | -54℃ | -27℃ | -54℃ | -27℃ | -54℃ |
由以上数据推断:
熔点为234℃的一溴代二甲苯的结构简式为____________;熔点为-27℃的二甲苯的名称为____________;
II.治疗甲型H1N1流感的常见药物有奥司他韦、扎那米韦、金刚乙胺及金刚烷胺以及预防药物如中药材金银花、大青叶等。其中金刚烷胺可按下列路线合成:

已知狄尔斯阿德耳反应(也称双烯合成反应)如下所示:

试回答下列问题:
(1)B的结构式为________________(填键线式)。
(2)上述物质中,属于同分异构体的是________(填字母)。
(3)上述反应中,属于加成反应的是________(填数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5.1镁铝混合物放入足量氢氧化钠溶液中充分反应后,生成气体在标准状况的体积为2.24L。
计算:(请写详细的计算步骤)
(1)混合物中含有镁的质量为多少克____________?
(2)若反应完成后,溶液体积为50mL,则溶液中含铝化合物的物质的量浓度为多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种现代工业应用广泛的优良金属,使用量可能会超过金属铁。工业上冶炼金属钛的方法有多种,下列反应原理是比较常见的冶炼钛的一种方法:
①TiO2+2Cl2 +2C![]() TiCl4+2CO;②TiCl4+2Mg
TiCl4+2CO;②TiCl4+2Mg ![]() Ti+2MgCl2。
Ti+2MgCl2。
请回答下列问题:
(1)与钛同周期元素中未成对电子数最多的基态原子的电子排布式为_________________。
(2)反应①中涉及的非金属元素电负性由大到小的顺序为_________(用元素符号表示);与CO互为等电子体的离子为__________(填化学式,写一种即可)。
(3)①TiCl4在常温下是无色液体,分子中4 个氯原子不在一个平面上,TiCl4空间构型为____,该物质能否溶解在苯溶剂中__________(填“能”或“否”) 。
②三氯化钛与酒石酸(![]() )反应,制得新的固态配合物酒石酸羟基钛(III)[Ti(OH)(C4H4O6)·1.5H2O),在酒石酸中,羧基氧原子的轨道杂化类型分别是_______,σ键和π键的数目比为__________,Ti3+能形成配合物的原因为____________。1个酒石酸分子中手性碳原子数有_____________个。
)反应,制得新的固态配合物酒石酸羟基钛(III)[Ti(OH)(C4H4O6)·1.5H2O),在酒石酸中,羧基氧原子的轨道杂化类型分别是_______,σ键和π键的数目比为__________,Ti3+能形成配合物的原因为____________。1个酒石酸分子中手性碳原子数有_____________个。
(4)钛酸钡晶体的结构示意图如图所示,若晶胞参数为a pm,则钛酸钡晶体的密度=_____g/cm3(阿伏加德罗常数用NA表示)。
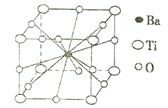
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】夹紧下列装置中的弹簧夹并进行相关操作。下列情形中,表明相应装置漏气的是( )
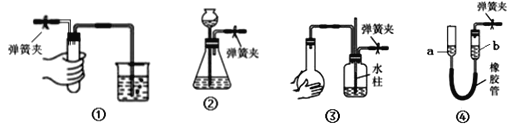
A. 装置①中,用手捂住试管,烧杯中出现气泡,放开手后,导管中形成一段稳定的水柱
B. 装置②中,向长颈漏斗中加入一定量水,形成水柱,随后水柱下降至与瓶中液面相平的位置
C. 装置③中,双手捂住烧瓶,导管中形成一段稳定的水柱,双手放开后,水柱慢慢回落
D. 装置④中,将a管向上提至一段高度,a、b两管之间水面形成稳定的高度差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:

(1)从开始至2min,X的平均反应速率为__________;
(2)该反应的化学方程式为_______________________;
(3)1min时,正逆反应速率的大小关系为:v(正)_____v(逆),2min时,v(正)_____v(逆)。(填“>”或“<”或“=”)
(4)若X、Y、Z均为气体,在2min时,向容器中通入氩气,增大体系压强,X的化学反应速率将______,若加入适合的催化剂,Y的化学反应速率将______。(填“变大”或“不变”或“变小”)
(5)若X、Y、Z均为气体,下列能说明反应已达平衡的是_____________。
a.X、Y、Z三种气体的浓度相等
b.气体混合物物质的量不再改变
c.反应已经停止
d.反应速率v(X)︰v(Y)=2:1
e.(单位时间内消耗X的物质的量):(单位时间内消耗Z的物质的量)=3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com