
【题目】设NA表示阿伏加德罗常数的值。下列说法不正确的是
A. 1mol过氧化钠与水完全反应,转移电子数为NA
B. 46g NO2与N2O4混合气体中含有原子数为3NA
C. 标准状况下,11.2LCCl4含有的分子数为0.5 NA
D. 含有0.1 NA个CO32-的Na2CO3固体的质量为10.6g
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某化工厂分析人员从生产车间取过氧化氢样品1.00mL于锥形瓶中,加入适量蒸馏水稀释,再用稀硫酸酸化后,逐滴加入0.10 mol·L-1的KMnO4溶液,当反应完全时,消耗KMnO4溶液25.00 mL,相关反应的化学方的程式为:2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O
(1)已知过氧化氢不稳定,试写出过氧化氢发生分解反应的化学方程式,并用双线桥标出电子转移的方向和数目_____________________________________________________。
(2)通过计算确定该过氧化氢样品的物质的量浓度(写出计算过程)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
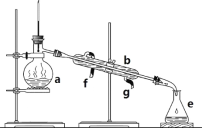

(1)写出下列仪器的名称:a.____________,b.___________,c.__________。
(2)仪器a~e中,使用前必须检查是否漏水的有___________。(填序号)
(3)若利用装置分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,温度计水银球的位置在_______处。冷凝水由____口流出(填f或g)。
(4)现需配制0.1mol/LNaOH溶液450mL,装置是某同学转移溶液的示意图。
①图中的错误是_____________________________。
②根据计算得知,所需NaOH的质量为_______。
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)_____________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若没有进行A操作___________;容量瓶用蒸馏洗涤后残留有少量的水_____________;若定容时俯视刻度线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中含有砷会导致砷中毒,金属冶炼过程产生的含砷有毒废弃物需处理与检测。冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
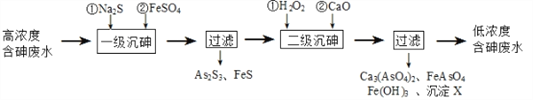
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷是第四周期VA族元素,则砷的原子序数为________;AsH3的电子式为____________;
(2)根据元素周期律,下列说法正确的是_________。
a.酸性:H2SO4>H3PO4>H3AsO4 b.原子半径:S>P>As
c.非金属性:S>P>As
(3)砷酸的第一步电离方程式为________________。
(4)沉淀X为_________________(填化学式)。
(5)“一级沉砷”中FeSO4的作用是____________________________________________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________________________。
(6)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应: Co2O3 + 6HCl(浓)= 2CoCl2+ Cl2↑ + 3H2O 。下列说法正确的是
A. HCl是氧化剂
B. Cl2被氧化,发生氧化反应
C. 还原性:CoCl2 > HCl
D. 该反应生成标准状况下11.2L Cl2,转移NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
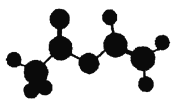
A. 该化合物的名称为乙酸乙酯
B. 该化合物与Br2的四氯化碳溶液不反应
C. 该化合物既能发生水解反应,又能发生氧化反应
D. 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的分离与提纯是化学的重点,根据下列实验目的,分别选择相应的实验装置。

(1)除去氯化钠晶体中的碳酸钠______。
(2)除去碳酸钙中的氯化钠______。
(3)分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合液(两者互溶):______。
(4)从溴水中提取溴______。
(5)除去氧化钙中的碳酸钙______。
(6)分离固体食盐和碘的方法______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组欲从工业废钒催化剂中回收V2O5,通过分析知该废钒催化剂的主要成分如下表:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~29 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
他们通过查阅资料找到一种废钒催化剂的回收工艺流程路线如下:
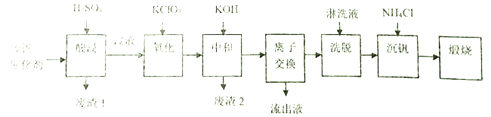
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则“废渣1”的主要成分是_____________。
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式________________________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有__________(用化学式表示)。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉定的化学方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com