
【题目】饮用水中含有砷会导致砷中毒,金属冶炼过程产生的含砷有毒废弃物需处理与检测。冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
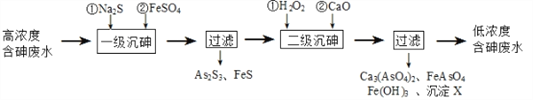
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷是第四周期VA族元素,则砷的原子序数为________;AsH3的电子式为____________;
(2)根据元素周期律,下列说法正确的是_________。
a.酸性:H2SO4>H3PO4>H3AsO4 b.原子半径:S>P>As
c.非金属性:S>P>As
(3)砷酸的第一步电离方程式为________________。
(4)沉淀X为_________________(填化学式)。
(5)“一级沉砷”中FeSO4的作用是____________________________________________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________________________。
(6)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________________
【答案】 33 ![]() ac H3AsO4
ac H3AsO4![]() H++H2AsO4- CaSO4 沉淀过量的S2-,使As2O3(a)+3S2-(aq)
H++H2AsO4- CaSO4 沉淀过量的S2-,使As2O3(a)+3S2-(aq)![]() 2AsS32-(aq)平衡左移,提高沉砷效果 H3AsO3+H2O2=H3AsO4+H2O 4FeS2+15O2+14H2O
2AsS32-(aq)平衡左移,提高沉砷效果 H3AsO3+H2O2=H3AsO4+H2O 4FeS2+15O2+14H2O![]() 4Fe(OH)3+8SO42+16H+
4Fe(OH)3+8SO42+16H+
【解析】(1)砷是第四周期VA族元素,则砷的原子序数为33,AsH3为共价化合物,AsH3的电子式为![]() ;正确答案:33;
;正确答案:33; ![]() 。
。
(2)非金属性越强,最高价氧化物的水化物的酸性就越强,非金属性S>P>As,所以酸性:H2SO4>H3PO4>H3AsO4,a正确;同一周期从左到右,原子半径逐渐减小;同一主族,从上到下,原子半径逐渐增大;因此原子半径:As>P>S;b错误;非金属元素的原子半径越小,元素的非金属性就越强,因此非金属性:S>P>As,c正确;正确答案:ac。
(3)H3AsO4为三元弱酸,能发生三步电离,第一步电离方程式为H3AsO4![]() H++H2AsO4- ;正确答案:H3AsO4
H++H2AsO4- ;正确答案:H3AsO4![]() H++H2AsO4- 。
H++H2AsO4- 。
(4)未完全沉淀的![]() 可被
可被![]() 氧化为
氧化为![]() ,
,![]() 溶于水后生成
溶于水后生成![]() ,
,![]() 与
与![]() 反应生成
反应生成![]() 沉淀;正确答案:CaSO4。
沉淀;正确答案:CaSO4。
(5)“一级沉砷”中FeSO4的作用是沉淀过量的S2-,使As2O3(a)+3S2-(aq)![]() 2AsS32-(aq)平衡左移,提高沉砷效果; “二级沉砷”中H2O2与含砷物质反应的化学方程式为H3AsO3+H2O2=H3AsO4+H2O ;正确答案:沉淀过量的S2-,使As2O3(a)+3S2-(aq)
2AsS32-(aq)平衡左移,提高沉砷效果; “二级沉砷”中H2O2与含砷物质反应的化学方程式为H3AsO3+H2O2=H3AsO4+H2O ;正确答案:沉淀过量的S2-,使As2O3(a)+3S2-(aq)![]() 2AsS32-(aq)平衡左移,提高沉砷效果; H3AsO3+H2O2=H3AsO4+H2O。
2AsS32-(aq)平衡左移,提高沉砷效果; H3AsO3+H2O2=H3AsO4+H2O。
(6)黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-; FeS2被O2氧化的离子方程式为4FeS2+15O2+14H2O![]() 4Fe(OH)3+8SO42+16H+;正确答案:4FeS2+15O2+14H2O
4Fe(OH)3+8SO42+16H+;正确答案:4FeS2+15O2+14H2O![]() 4Fe(OH)3+8SO42+16H+。
4Fe(OH)3+8SO42+16H+。


科目:高中化学 来源: 题型:
【题目】磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟(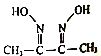 )氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
)氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1)写出基态Ni2+的核外电子排布式:___________。
(2)丁二酮肟分子中四种元素电负性由大到小的顺序为_______,该分子中π键和δ键的个数比为______,其中N原子的轨道杂化方式为________。
(3)过量NH3与F2在铜催化作用下反应生成NF3分子。NF3分子的VSEPR模型为_______。
(4)向Ni(NO3)2溶液中滴加氨水,刚开始时生成绿色Ni(OH)2沉淀,当氨水过量时,沉淀会溶解,生成[Ni(NH3)6]2+的蓝色溶液,写出此沉淀溶解的离子方程式: ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 常温常压下,48g O2和O3的混合气体中含有氧原子数为3NA
B. 17 g氨气所含质子数目为11NA
C. 标准状况下22.4L的四氯化碳,含有四氯化碳分子数为NA
D. 物质的量浓度为0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据科学人员探测,在海洋深处的沉积物中含有可燃冰,主要成分是甲烷水合物。有关其组成的两种分子的下列说法正确的是( )
A. 它们都是极性键构成的极性分子 B. 它们之间以氢键结合在一起
C. 它们的成键电子的原子轨道都是sp3—s D. 它们的立体结构都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是常见的二次电池,电池总反应为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O下列说法正确的是
2PbSO4+2H2O下列说法正确的是
A. 放电时PbO2发生氧化反应
B. 充电时电解质溶液的质量减少
C. 放电时的负极反应式为Pb+SO42--2e-= PbSO4
D. 充电时的阴极反应式为PbSO4+2H2O-2e-= PbO2+SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2==2H2O,下列有关说法正确的是()

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-=4OH-
C. 每转移0.1 mol电子,便消耗1.12 升的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法不正确的是
A. 1mol过氧化钠与水完全反应,转移电子数为NA
B. 46g NO2与N2O4混合气体中含有原子数为3NA
C. 标准状况下,11.2LCCl4含有的分子数为0.5 NA
D. 含有0.1 NA个CO32-的Na2CO3固体的质量为10.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. 乙酸乙酯制备:CH3COOH + CH3CH218OH![]() CH3COOCH2CH3 + H218O
CH3COOCH2CH3 + H218O
B. 乙醛与新制氢氧化铜悬浊液共热:CH3CHO + 2Cu(OH)2 + NaOH ![]() CH3COONa + Cu2O↓+ 3H2O
CH3COONa + Cu2O↓+ 3H2O
C. 苯酚钠溶液中通入少量二氧化碳:2![]() + CO2 + H2O
+ CO2 + H2O ![]() 2
2![]() + Na2CO3
+ Na2CO3
D. 1-溴丙烷在NaOH醇溶液中加热:CH3CH2CH2Br+NaOH![]() CH3CH2CH2OH+NaBr
CH3CH2CH2OH+NaBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z 在周期表中的相对位置如图所示。已知: Y的最高价氧化物对应的水化物既能与强碱反应,又能与强酸反应。下列说法不正确的是
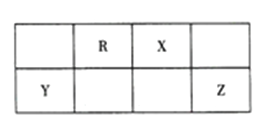
A. 简单气态氢化物的热稳定性: R<X
B. Y、Z的简单离子在同一溶液中能大量共存
C. 工业上,采用电解法冶炼单质Y
D. RZ2是含极性键的共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com