
【题目】磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟(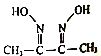 )氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
)氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1)写出基态Ni2+的核外电子排布式:___________。
(2)丁二酮肟分子中四种元素电负性由大到小的顺序为_______,该分子中π键和δ键的个数比为______,其中N原子的轨道杂化方式为________。
(3)过量NH3与F2在铜催化作用下反应生成NF3分子。NF3分子的VSEPR模型为_______。
(4)向Ni(NO3)2溶液中滴加氨水,刚开始时生成绿色Ni(OH)2沉淀,当氨水过量时,沉淀会溶解,生成[Ni(NH3)6]2+的蓝色溶液,写出此沉淀溶解的离子方程式: ____________。
【答案】 [Ar]3d8 O>N>C>H 2:15 sp2 四面体型 Ni(OH)2+6NH3·H2O=[Ni(NH3)6]2++2OH-+6H2O
【解析】(1)考查电子排布式的书写,Ni的核外电子排布式为[Ar]3d84s2,(2)考查电负性规律、化学键的数目、杂化类型的判断,含有的四种元素是H、C、N、O,同周期从左向右电负性增强,即电负性由大到小的顺序是O>N>C>H;成键原子之间只能形成一个σ键,双键之间有1个σ键和π键,因此个数比为2:15;N有2个σ键,1个孤电子对,因此杂化类型为sp2;(3)VSEPR模型的判断,NF3中N有3个σ键,,孤电子对数为(5-3×1)/2=1,价层电子对数为4,即VSEPR模型为四面体;(4)考查配合物的生成,离子方程式为: Ni(OH)2+6NH3·H2O=[Ni(NH3)6]2++2OH-+6H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】功能高分子P的合成路线如下:
(1)反应②所需的反应试剂和条件是_____________。
(2)反应④所需的反应试剂和条件是_____________。
(3)反应①的化学反应方程式为_____________。
(4)反应③的化学反应方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒的新药。合成丁苯酞(J)的一种路线如下:


(1)A的名称是_______________,A分子中最多有_____个原子共平面。
(2)B生成A的化学方程式______________________。
(3)D生成E的反应类型为_________,试剂a是_________。
(4)F的结构简式_____________________。
(5)J是一种酯,分子中除苯环外还含有一个五元环。写出H生成J的化学方程式_____(注明反应条件)。
(6)![]() ,X的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X的同分异构体共有______种,写出其中核磁共振氢谱有五组吸收峰的结构简式___________________。
,X的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X的同分异构体共有______种,写出其中核磁共振氢谱有五组吸收峰的结构简式___________________。
(7)利用题中信息和所学知识,写出以甲烷和化合物D为原料,合成 ![]() 的路线流程图____________________(其它试剂自选)。
的路线流程图____________________(其它试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用锌片与稀硫酸反应制取氢气,下列措施不能使氢气的生成速率增大的是( )
A. 加热 B. 将锌片改成锌粉
C. 滴加少量CuSO4溶液 D. 加入适量Na2CO3粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.第三周期的元素的原子核外都有三个电子层
B.第ⅠA族元素都是典型的金属元素
C.氟、氯、氧、氮四种元素都是第ⅦA族的元素
D.原子的最外层有两个电子的元素都在第ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂分析人员从生产车间取过氧化氢样品1.00mL于锥形瓶中,加入适量蒸馏水稀释,再用稀硫酸酸化后,逐滴加入0.10 mol·L-1的KMnO4溶液,当反应完全时,消耗KMnO4溶液25.00 mL,相关反应的化学方的程式为:2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O
(1)已知过氧化氢不稳定,试写出过氧化氢发生分解反应的化学方程式,并用双线桥标出电子转移的方向和数目_____________________________________________________。
(2)通过计算确定该过氧化氢样品的物质的量浓度(写出计算过程)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式或离子方程式正确的是
A. 1-氯丙烷中加入氢氧化钠溶液并加热:CH3CH2CH2Cl + NaOH ![]() CH3CH=CH2↑ + NaCl + H2O
CH3CH=CH2↑ + NaCl + H2O
B. 苯酚钠溶液中通入少量二氧化碳:2C6H5O﹣+ CO2 + H2O → 2C6H5OH + CO32﹣
C. 乙醛与碱性氢氧化铜悬浊液混合后加热至沸腾:CH3CHO+2Cu(OH)2+OH﹣![]() Cu2O↓+CH3COO﹣+3H2O
Cu2O↓+CH3COO﹣+3H2O
D. 向小苏打溶液中加入醋酸:CO32﹣+2CH3COOH=CO2↑+H2O+2CH3COO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
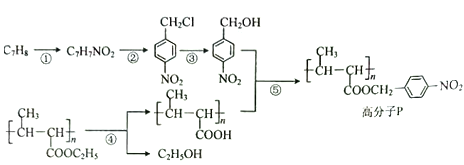
【题目】饮用水中含有砷会导致砷中毒,金属冶炼过程产生的含砷有毒废弃物需处理与检测。冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷是第四周期VA族元素,则砷的原子序数为________;AsH3的电子式为____________;
(2)根据元素周期律,下列说法正确的是_________。
a.酸性:H2SO4>H3PO4>H3AsO4 b.原子半径:S>P>As
c.非金属性:S>P>As
(3)砷酸的第一步电离方程式为________________。
(4)沉淀X为_________________(填化学式)。
(5)“一级沉砷”中FeSO4的作用是____________________________________________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________________________。
(6)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com