
【题目】功能高分子P的合成路线如下:
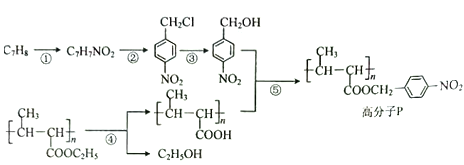
(1)反应②所需的反应试剂和条件是_____________。
(2)反应④所需的反应试剂和条件是_____________。
(3)反应①的化学反应方程式为_____________。
(4)反应③的化学反应方程式为_____________。
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是
A. CO的摩尔质量为28g
B. 1mol·L-1 NaOH溶液中所含有Na+数目为NA
C. 8g NH4NO3中含有0.2mol N原子
D. 0.5mol H2所占的体积约为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g) 在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加Fe(s)的量
B.将容器的体积缩小一半
C.升高温度
D.通入水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述不正确的是( )

A. 汉黄芩素的分子式为C16H12O5
B. 该物质遇FeCl3溶液显色
C. 1mol该物质与溴水反应,最多消耗2mol Br2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组用下图装置(夹持装置略)收集某葡萄酒中的SO2,并对含量进行测定。实验步骤如下
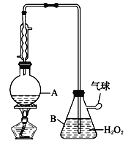
i. 检查装置的气密性后,向仪器A中加入300.00ml葡萄酒和适量盐酸
ii. 加热使SO2全部逸出并与B中H2O2完全反应
iii. 除去B中过量的H2O2后,将B中溶液取出,稀释至100mL
iv.取25.00mL 稀释后的溶液至于锥形瓶中,加入几滴酚酞
v.用0.0300mol/L NaOH标准溶液进行滴定,重复三次
(1)SO2在水中可形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用化学方程式表示为_______________。
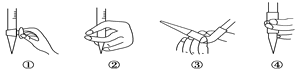
(2)图中①中仪器名称为_____________,步骤v中,滴定前排气泡时,应选择图中的___。
(3)除去过量H2O2的方法是_________________。
(4)滴定的终点现象_____________________________________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积 (填序号)___________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(5)滴定消耗的NaOH溶液的体积如下,则该葡萄酒中SO2含量为____g/L。
滴定次数 | 1 | 2 | 3 |
NaOH溶液体积/mL | 21.80 | 20.02 | 19.98 |
(6)某同学认为该测定结果不能说明该葡萄酒中SO2残留量一定超标。原因是__________。利用现有装置可以如何改进?_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白黎芦醇具有抗氧化和预防心血管疾病的作用。可通过以下方法合成:

(1)化合物B中的含氧官能团的名称为___________________。
(2)下列说法正确的是_____________
A.可用NaHCO3溶液鉴别化合物A和白黎芦醇
B.1molB最多能与4mol氢气加成
C.1mol白黎芦醇最多能与3.5mol溴水发生反应
D.化合物F中含有1个手性碳原子
(3)由F-G的反应类型是__________。
(4)D的结构简式为___________。
(5)写出同时满足下列条件的C的一种同分异构体的结构简式:__________。
①能发生银镜反应,与FeCl3溶液不显色;
②能发生水解反应,水解产物之一能与FeCl3溶液显色;
③分子中含有4种不同化学环境的氢。
(6)请写出以苯甲醛为原料制备![]() 合成路线流程图(无机试剂可任选)。合成路线流程图例见本题题干)。______________
合成路线流程图(无机试剂可任选)。合成路线流程图例见本题题干)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,在原理上可以设计成原电池的是( )
A.Ba(OH)28H2O与NH4Cl的反应
B.铝片与浓硫酸的反应
C.甲烷与氧气的反应
D.石灰石的分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟(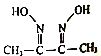 )氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
)氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1)写出基态Ni2+的核外电子排布式:___________。
(2)丁二酮肟分子中四种元素电负性由大到小的顺序为_______,该分子中π键和δ键的个数比为______,其中N原子的轨道杂化方式为________。
(3)过量NH3与F2在铜催化作用下反应生成NF3分子。NF3分子的VSEPR模型为_______。
(4)向Ni(NO3)2溶液中滴加氨水,刚开始时生成绿色Ni(OH)2沉淀,当氨水过量时,沉淀会溶解,生成[Ni(NH3)6]2+的蓝色溶液,写出此沉淀溶解的离子方程式: ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 常温常压下,48g O2和O3的混合气体中含有氧原子数为3NA
B. 17 g氨气所含质子数目为11NA
C. 标准状况下22.4L的四氯化碳,含有四氯化碳分子数为NA
D. 物质的量浓度为0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为1 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com