
����Ŀ������һ��������Na2O���ʵ�Na2O2���������ⶨNa2O2�����Ĵ��ȡ��ɹ�ѡ�õķ�Ӧ��ֻ��CaCO3���塢6mol��L��1���ᡢ6mol��L��1���������ˮ����֪����Ũ��������ˮ�ԡ���ˮ�Ժ�ǿ�����ԣ��ڼ�ʯ�ҵijɷ�ΪCaO��NaOH��ʵ�鷽��Ϊ�����Ʊ����ᴿCO2���ڽ�������CO2ͨ���������۲ⶨ����O2��������ܸ���O2���������Na2O2�����Ĵ��ȡ�ʵ��װ�����£�

�ش��������⣺
��1��װ��A�з�����Ӧ�����ӷ���ʽ��______________________________________��
��2��װ��B��������_______________________��װ��C��������_______��
��3��װ��E��������__________________________________________
��4��װ��D�з�����Ӧ�Ļ�ѧ����ʽ��______________________________________��
��5������ʼʱ�����Ʒ������Ϊ2.0g����Ӧ���������������Ϊ224mL(��״��)����Na2O2�����Ĵ���Ϊ________��
���𰸡� CaCO3+2H+=Ca2++H2O+CO2�� ��ȥ�����е�HCl �������� ��ֹˮ�������뵽D�У����������ն����CO2 2Na2O2��2CO2��2Na2CO3��O2 Na2O��CO2��Na2CO3 78%
����������1��ʵ������ȡ������̼ѡ��CaCO3������ϡ���ᷴӦ����ȡ��װ��A��CaCO3���������ᷴӦ�����Ȼ��ơ�������̼��ˮ��������Ӧ�����ӷ���ʽ�ǣ�CaCO3+2H+=Ca2++H2O+CO2������2�������ӷ�����Ӧ���Ƿ��ȷ�Ӧ���ƵõĶ�����̼�к����Ȼ��⣬����װ��B��ȥ�����е�HCl���壻װ��Cװ��Ũ���ᣬ�������Ǹ������壻��3��������̼����ˮ������������̼��Ӧ��װ��E�������Ƿ�ֹˮ�������뵽D�У����������ն����CO2����4��װ��D�и���Ķ�����̼��������Ʒ�Ӧ����̼���ƺ��������������Ʒ�Ӧ����̼���ƣ�������Ӧ�Ļ�ѧ����ʽ�ֱ��ǣ�2Na2O2��2CO2��2Na2CO3��O2��Na2O��CO2��Na2CO3����5�����ݷ�Ӧ2Na2O2+2CO2=2Na2CO3+O2����Ӧ���������������Ϊ224mL����״���������ɵ����������ʵ���Ϊ��n��O2��=![]() =0.01mol���������Ƶ����ʵ���Ϊ��n��Na2O2��=2n��O2��=0.02mol���������ƵĴ���Ϊ���أ�Na2O2��=
=0.01mol���������Ƶ����ʵ���Ϊ��n��Na2O2��=2n��O2��=0.02mol���������ƵĴ���Ϊ���أ�Na2O2��=![]() ��100%=78%��
��100%=78%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�������ķ�չ���������ϵķ�չ�ܲ��ɷ֣������������ೣ�õ�һ�������ͭ�����Ͻ�ȵȡ�
��1����̬Cuԭ�ӵļ۵����Ų�ʽΪ__________����Ԫ�����ڱ��е�λ��Ϊ___________��
��2��Cu2OΪ�뵼����ϣ�������ȩ��CH3CHO��������������ͭ��Ӧ�õ�����ȩ��̼ԭ�ӵ��ӻ���ʽ��______________����ȩ������![]() ����
����![]() ������Ŀ֮��Ϊ____________��
������Ŀ֮��Ϊ____________��
��3�����쵥����̫���ܵ��Ƭʱ��һ���������ͭ��̼���𡢵��ȡ�ͭ��̼���𡢵�Ԫ�صĵ縺���ɴ�С��˳����_________________������Ԫ�ط��ű�ʾ��
��4��Cu(OH)2���ڰ�ˮ�γ�����ɫ��[Cu(NH3)4]2+�����������NH3�ļ۲���ӶԻ���ģ��Ϊ_____________��
��5�����ڲ�ͬ�¶ȷ�Χ�в�ͬ�ľ���ṹ����������Ϊ�������������¶����ߵ�912�棬��ת��Ϊ�����������������������ѻ��������������ܶѻ�����λ���ֱ�Ϊ____��_____������ԭ�Ӱ뾶Ϊr pm������Ϊ�����������ܶѻ�ʱ�ľ����ܶ�Ϊ___________g/cm3������٤��������ֵ��NA ��ʾ��1pm=10-12m,д������ʽ���ɣ���

������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����ý�̿��ʯ��Ҥ��ȼ�շ��ȣ�ʹʯ��ʯ�ֽ�����CO2����Ҫ��Ӧ���£�
C+O2��CO2 ���� CaCO3��CO2��+CaO ��
��1����̼���95%��ʯ��ʯ2.0 t������ȫ�ֽ⣨�����ʲ��ֽ⣩���ɵñ�״����CO2�����Ϊ_________________m3��
��2��������CaCO3�ͽ�̿���٢���ȫ��Ӧ����Ҥ�������![]() =2.2ʱ��Ҥ����CO2������������Ϊ���٣��������ֻ��N2��O2���������Ϊ4��1����ͬ��
=2.2ʱ��Ҥ����CO2������������Ϊ���٣��������ֻ��N2��O2���������Ϊ4��1����ͬ��
��3��ij��Ҥ���ɷ����£�O2 0.2%��CO 0.2%��CO2 41.6%������ΪN2����˴�Ҥ�������![]() Ϊ��ֵ��
Ϊ��ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����ͬ���칹��������( )
A. ���� B. C3H6Cl2 C. �ڶ��ױ� D. 2 ����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ԫ���У�����ͬһ���ڵ���
A. Na��K B. N��Al C. S��Cl D. H��O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e��ԭ��������������A�ĺ����������������������ͬ��b�ļ۵��Ӳ��е�δ�ɶԵ�����3����c������������Ϊ���ڲ��������3����d��cͬ�壻e�������ֻ��1�����ӣ����������18�����ӡ��ش��������⣺
��1��b��c��d�е�һ������������_____ ����Ԫ�ط��ţ���e�ļ۲�����Ų�ͼΪ__________��
��2��a������Ԫ���γɵĶ�Ԫ���ۻ������У����ӳ������Σ��÷��ӵ�����ԭ�ӵ��ӻ���ʽΪ ________ �������мȺ��м��Թ��ۼ����ֺ��зǼ��Թ��ۼ��Ļ�������__________���ѧʽ��д�����֣���
��3����ЩԪ���γɵĺ������У����ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ3������___������������ṹ������ _____________ �����ѧʽ��
��4��e��c�γɵ�һ�����ӻ�����ľ���ṹ��ͼ1����e���ӵĵ��Ϊ__________��
��5����5��Ԫ���γɵ�һ��1��1�����ӻ������У������ӳ�������ṹ�������ӳ����������İ�����ṹ����ͼ2��ʾ����

�û�������������Ϊ ______ ���������д��ڵĻ�ѧ��������_____________ ���û��������ʱ����ʧȥ�������________ ���ж�������____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʲ��������������ᡢ�Ҵ���������( )
A. ������ B. ��ˮ C. ̼������Һ D. ��ɫʯ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʾ��ͼ���Ӧ�ķ�Ӧ�����ȷ���ǣ� ��
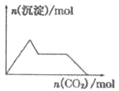
A. ��0.0l mol KOH��0.01 mol Ca��OH��2�Ļ����Һ�л���ͨ��CO2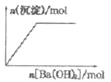
B. NaHSO4��Һ����μ���Ba��OH��2��Һ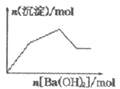
C. KAl��SO4��2��Һ����μ���Ba��OH��2��Һ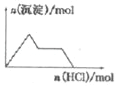
D. NaAlO2��Һ����μ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������500 mL0.5 mol��L��1��NaOH��Һ���Իش��������⣺
��1�����㣺��ҪNaOH���������Ϊ____________��(��ȷ��0.1g)
��2�����������������ձ� ��100ml��Ͳ ��1000ml����ƿ ��500mL����ƿ �ݲ����� ��������ƽ�������룩 �ߵζ���
����������ʱ������ʹ�õ�������_____������ţ�����ȱ�ٵ�������__��
������ʵ�������õ��������������÷ֱ��ǣ�______________��_____________��
��������ʱ��һ��ɷ�Ϊ���¼������裺�ٳ����ڼ�����ܽ��ҡ�Ȣ�ת�Ƣ�ϴ�Ӣ߶��ݢ���ȴ������ȷ�IJ���˳��Ϊ_______________
��3��ijѧ��ʵ������NaOH��Һ��Ũ��Ϊ0.48 mol��L��1��ԭ�������_______��
A��ʹ����ֽ�����������ƹ���
B������ƿ��ԭ��������������ˮ
C���ܽ����ձ�δ�����ϴ��
D����ͷ�ιܼ�ˮ����ʱ���ӿ̶���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com