
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。A的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是_____ (填元素符号),e的价层电子排布图为__________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ________ ;分子中既含有极性共价键、又含有非极性共价键的化合物是__________(填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是___;酸根呈三角锥结构的酸是 _____________ 。(填化学式)
(4)e和c形成的一种离子化合物的晶体结构如图1,则e离子的电荷为__________。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。

该化合物中阴离子为 ______ ,阳离子中存在的化学键类型有_____________ ;该化合物加热时首先失去的组分是________ ,判断理由是____________________。
【答案】 N ![]() sp3 H2O2 N2H4 HNO2 HNO3、H2SO3 +1 SO42― 共价键和配位键 H2O H2O与Cu2+的配位键比NH3与Cu2+的弱
sp3 H2O2 N2H4 HNO2 HNO3、H2SO3 +1 SO42― 共价键和配位键 H2O H2O与Cu2+的配位键比NH3与Cu2+的弱
【解析】周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,则a为H元素;
c的最外层电子数为其内层电子数的3倍,最外层电子数不超过8个,则c是O元素;
b的价电子层中的未成对电子有3个,且原子序数小于c,则b是N元素;
e的最外层只有1个电子,但次外层有18个电子,则e原子核外电子数为2+8+18+1=29,为Cu元素;
d与c同族,且原子序数小于e,所以d为S元素,
(1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素,同一主族元素中,元素第一电离能随着原子序数增大而减小,所以b、c、d元素第一电离能最大的是N元素;e的价层电子为3d、4s电子,其价层电子排布图为![]() ;
;
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子为NH3,该分子的中心原子含有3个共价单键和一个孤电子对,所以N原子的杂化方式为sp3;分子中既含有极性共价键、又含有非极性共价键的化合物有H2O2和N2H4;
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是HNO2、HNO3;酸根呈三角锥结构的酸是H2SO3;
(4)该晶胞中c离子个数=1+8×![]() =2,e离子个数4,该晶胞中氧离子和铜离子个数之比=2:4=1:2,所以e和c形成的一种离子化合物化学式为Cu2O,则e离子的电荷为+1;
=2,e离子个数4,该晶胞中氧离子和铜离子个数之比=2:4=1:2,所以e和c形成的一种离子化合物化学式为Cu2O,则e离子的电荷为+1;
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,说明该阴离子价层电子对个数是4且不含孤电子对,为SO42-;阳离子呈轴向狭长的八面体结构,根据图知,其阳离子中铜离子配位数是8,在八面体上下顶点上分子含有两个共价键且含有两个孤电子对,为水分子,有两个,正方形平面上四个顶点上分子含有3个共价键且含有一个孤电子对,所以为氨气分子,有4个,所以阳离子中含有配位键和共价键;H2O和Cu2+的配位键比NH3与Cu2+的弱,所以该化合物加热时首先失去的组分是H2O。


科目:高中化学 来源: 题型:
【题目】
尼龙是世界上出现的第一种合成纤维。尼龙的出现使纺织品的面貌焕然一新,它的合成是合成纤维工业的重大突破,同时也是高分子化学的一个重要里程碑。下图是以1,3—丁二烯为原料来合成尼龙66的路线:

已知:

③A存在顺反异构
根据以上信息回答下列问题:
(1)下列关于有机高分子化合物的说法正确的是________。
A.有机高分子化合物均可水解为小分子
B.淀粉和纤维素的分子式均为(C6H10O5)n,它们互为同分异构体
C.蛋白质的盐析过程是物理变化
D.因蛋白质在高温下易变性,所以疫苗保存时需冷藏
(2)有机物A的结构简式为_______________,A→B的反应类型为___________。
(3)D中所含官能团的名称为_______________________。
(4)写出C+E→F的化学方程式______________。
(5)与E官能团相同的同分异构体有______种(不包括E),写出其中核磁共振氢谱有4组吸收峰且峰面积之比为2:4:1:3的结构简式________________。
(6)已知:

以CH2=CH2为原料,其他无机试剂任选合成 
结合本题信息写出合成路线_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 常温常压下,56 g乙烯和丙烯的混合气中含有的碳原子数为4NA
B. 1.2 g NaHSO4晶体中含有的阳离子和阴离子的总数为0.03NA
C. 12 g金刚石中含有的共价键数为4NA
D. 1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2+ +2HCO3-+2OH-=CaCO3↓+CO32-+H2O
B.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-![]() 3Fe3++NO↑+3H2O
3Fe3++NO↑+3H2O
C.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4 Fe2++2 Br-+3Cl2=4Fe3++6Cl-+Br2
D.以铜为电极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,欲测定Na2O2试样的纯度。可供选用的反应物只有CaCO3固体、6mol·L-1硫酸、6mol·L-1盐酸和蒸馏水。已知:①浓硫酸有吸水性、脱水性和强氧化性,②碱石灰的成分为CaO和NaOH。实验方案为:①制备并提纯CO2。②将纯净的CO2通过试样。③测定生成O2的体积。④根据O2的体积计算Na2O2试样的纯度。实验装置如下:

回答下列问题:
(1)装置A中发生反应的离子方程式是______________________________________。
(2)装置B的作用是_______________________,装置C的作用是_______。
(3)装置E的作用是__________________________________________
(4)装置D中发生反应的化学方程式是______________________________________。
(5)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液导电能力取决于自由移动离子的浓度和所带电荷数,离子浓度越大,所带电荷数越多,溶液导电能力越强。现有浓度均为1mol/L的以下电解质溶液:①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧![]() ⑨
⑨![]() ⑩
⑩![]() 请回答相关问题。
请回答相关问题。
(1)这些溶液中导电能力最强的是_______(填溶质化学式),其电离方程式为_______。写出一种导电原理与电解质溶液不同的物质名称 _________。
(2)以上溶液两两混合后溶液的导电能力有多种变化趋势,请写出符合要求的组合(不考虑温度变化,填序号,如①和②)。导电能力变化符合图1的组合是_________(任写一组);导电能力变化符合图2的组合是__________,混合过程中发生反应的离子方程式是_________;①的溶液和_______(任写一种)的溶液混合导电能力变化符合图3且两溶液体积相等时导电能力最弱,溶液导电能力最弱时溶质的物质的量浓度为 ____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 标准状况下,11.2LSO2气体中含氧原子数等于18g水中含有的氧原子数
B. 5.6 g铁与足量稀硫酸反应失去的电子的物质的最为0.3 mol
C. 100g98%的浓硫酸所含的氧原子个数为4mol
D. 20gNaOH溶于1L水,所得溶液中c(Na+)=0.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质.实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:

经查阅资料:①HBr(氢溴酸)为一元强酸;
②Al3+、Fe3+在pH=8时完全转化为沉淀。
③V为IV过滤后的溶液。
(1)写出I溶解的离子方程式:_________________________________________。
(2)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸(密度为1.49g/cm)配置26%的氢溴酸500 mL,所需的玻璃仪器有玻璃棒、胶头滴管、___________。
(3)已知步骤Ⅲ的滤液中不含NH4+.步骤Ⅱ加入的试剂a是_____________(填化学式)。
A.NaOH B. Ba(OH)2 C. NH3·H2O D. Ca(OH)2
(4)步骤Ⅴ所含的操作依次是__________________、__________________、过滤。
(5)制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④烘干,冷却。⑤称量.若得到1.88g碳酸钙,则溴化钙的质量分数为_________________ (保留两位小数),若实验操作规范而测定结果偏低,其原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为________________。
②用CO、O2和固体电解质还可以制成如下图1所示的燃料电池,则电极d的电极反应式为______________。
(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示。
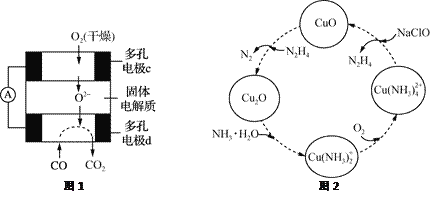
①在图示2的转化中,化合价不变的元素是_________(填元素名称)。
②在转化过程中通入氧气发生反应后,溶液的pH将________(填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为________。
③加入NaClO时发生的反应为:Cu(NH3)![]() +2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
+2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有________、________
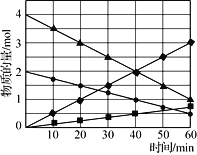
图3
(3)CO与SO2在铝矾土作催化剂、773 K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com