
【题目】CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为________________。
②用CO、O2和固体电解质还可以制成如下图1所示的燃料电池,则电极d的电极反应式为______________。
(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示。
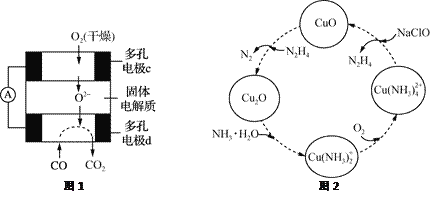
①在图示2的转化中,化合价不变的元素是_________(填元素名称)。
②在转化过程中通入氧气发生反应后,溶液的pH将________(填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为________。
③加入NaClO时发生的反应为:Cu(NH3)![]() +2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
+2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有________、________
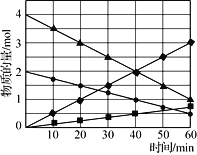
图3
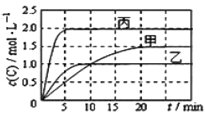
(3)CO与SO2在铝矾土作催化剂、773 K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式:____________。
【答案】(1)①2CO+O2+4OH-![]() 2CO32—+2H2O。②CO-2e-+O2-
2CO32—+2H2O。②CO-2e-+O2-![]() CO2。
CO2。
(2)①钠和氢。②增大。1mol。③使氢氧化铜分解、降低联氨的溶解度,使其从溶液中逸出。
(3)4CO+2SO2=4CO2+S2。
【解析】试题分析:(1)①该燃料电池中,负极上CO失电子发生氧化反应生成二氧化碳,正极上氧气得电子发生还原反应生成氢氧根离子,二氧化碳和氢氧根离子反应生成碳酸根离子和水,所以电池反应式为2CO+O2+4 OH-="2" CO32-+2H2O,故答案为:2CO+O2+4 OH-="2" CO32-+2H2O。
②d电极上CO生成二氧化碳,则该电极上失电子发生氧化反应,电极反应式为CO+O2--2e-=CO2,故答案为:CO+O2--2e-=CO2;
(2)根据图知,H、Na元素都在化合物中,化合价不变,故答案为:氢、钠;
②Cu(NH3)2+和氧气反应过程中,Cu元素化合价由+1价变为+2价,O元素化合价由0价变为-2价,氧气得电子和水反应生成氢氧根离子,所以溶液的pH增大;转化中当有1mol N2H4参与反应时,转移电子物质的量=1mol×2×[0-(-2)]=4mol,根据转移电子相等得需要消耗O2的物质的量=![]() =1mol,故答案为:增大;1mol;
=1mol,故答案为:增大;1mol;
③温度高时氢氧化铜分解,且气体溶解度随温度升高而降低,从而促进反应向正反应方向进行,故答案为:氢氧化铜分解、降低联氨溶解度使其从溶液中逸出;
(3)根据图象知,反应物的物质的量变化量一个为(4-1)mol=3mol、一个为(2-0.5)mol=1.5mol,生成物的物质的量变化量一个为(3-0)mol=3mol、一个为(0.75-0)mol=0.75mol,则反应物、生成物的物质的量变化量之比等于其计量数之比=3mol:1.5mol:3mol:0.75mol=4:2:4:1,根据C原子守恒知,计量数是4的为CO、CO2,二氧化硫的计量数是2,硫单质的计量数是1,则生成的硫单质为S2,所以反应方程式为4CO+2SO2=4CO2+S2,故答案为:4CO+2SO2=4CO2+S2。


科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。A的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是_____ (填元素符号),e的价层电子排布图为__________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ________ ;分子中既含有极性共价键、又含有非极性共价键的化合物是__________(填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是___;酸根呈三角锥结构的酸是 _____________ 。(填化学式)
(4)e和c形成的一种离子化合物的晶体结构如图1,则e离子的电荷为__________。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。

该化合物中阴离子为 ______ ,阳离子中存在的化学键类型有_____________ ;该化合物加热时首先失去的组分是________ ,判断理由是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。
容器 | 甲 | 乙 | 丙 |
容积 | 1L | 1L | 2L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
下列说法正确的是( )
A. 由图可知Tl<T2,且正反应为吸热反应
B. 前5min内甲、乙、丙三个容器中反应的平均速率:v (A)乙<v(A)甲<v(A)丙
C. 平衡时A的转化率a : a乙<a甲<a丙
D. T2时该反应的平衡常数K=1.33
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某固定体积的绝热密闭容器中进行的可逆反应A (g)+B(g)![]() C(s)+2D(g),可以说明己达到平衡状态的是( )
C(s)+2D(g),可以说明己达到平衡状态的是( )
①反应容器中压强不随时间变化而变化;②A气体和B气体的生成速率相等;③混合气体的平均摩尔质量不随时间变化而变化;④混合气体的密度不随时间变化而变化⑤化学平衡常数不变
A. ①④⑤ B. ③④ C. ①③④⑤ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制500 mL0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为____________。(精确到0.1g)
(2)有以下仪器:①烧杯 ②100ml量筒 ③1000ml容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦滴定管
(Ⅰ)配制时,必须使用的仪器有_____(填代号),还缺少的仪器是__;
(Ⅱ)实验两次用到玻璃棒,其作用分别是:______________、_____________。
(Ⅲ)配制时,一般可分为以下几个步骤:①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为_______________
(3)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是_______。
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤
D.胶头滴管加水定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类
(1)下图所示的物质分类方法名称是________。

(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学 式 | ①HCl ②____ | ③____ ④Ba(OH)2 | ⑤Na2CO3 ⑥____ | ⑦CO2 ⑧Na2O |
(3)写出⑦转化为⑤的化学方程式______________________________________________。
(4)实验室制备⑦常用________和________反应,检验该气体的方法是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】)常温下钛的化学活性很小,在较高温度下可与多种物质反应。
(1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:

① 沸腾氯化炉中发生的主要反应为:_____________。
② 己知:Ti (s)+2Cl2(g)=TiCl4(l) △H=akJ/mol;
2Na(s)+Cl2(g)=2NaCl(s) △H=bkJ/mol;
Na(s) = Na (l) △H=ckJ/mol
则TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s) △H=________kJ/mol
③ TiCl4遇水强烈水解,写出其水解的化学方程式________。
(2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示。二氧化钛电极连接电源_____极,该极电极反应为__________。

(3)若以二甲醚(CH3OCH3)、空气、氢氧化钾溶液为原料,多孔石墨为电极构成的燃料电池提供上述电解的电源,则该电池工作时负极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为 ( )
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 离子化合物中不可能含有共价键 B. 含有离子键的化合物必是离子化合物
C. 共价化合物可能含离子键 D. 含有共价键的化合物必是共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com