
����Ŀ����ס��ҡ��������ܱ������г���һ������A��B��������Ӧ��xA(g)+B(g)![]() 2C(g)���������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ�����ͼ���±���ʾ��
2C(g)���������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ�����ͼ���±���ʾ��
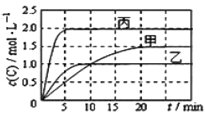
���� | �� | �� | �� |
�ݻ� | 1L | 1L | 2L |
�¶�/�� | T1 | T2 | T2 |
��Ӧ�� ��ʼ�� | 1molA 2molB | 1molA 2molB | 4molA 8molB |
����˵����ȷ���ǣ� ��
A. ��ͼ��֪Tl<T2��������ӦΪ���ȷ�Ӧ
B. ǰ5min�ڼס��ҡ������������з�Ӧ��ƽ�����ʣ�v (A)��<v(A)��<v(A)��
C. ƽ��ʱA��ת����a : a����a����a��
D. T2ʱ�÷�Ӧ��ƽ�ⳣ��K=1.33
���𰸡�D
��������A���Ƚϼ����ҿ�֪�����ȵ���ƽ�⣬���¶�T1��T2���¶�Խ��C��Ũ��Խ�ͣ������¶�ƽ�����淴Ӧ�ƶ���������ӦΪ���ȷ�Ӧ��A������B��Ч��Խ��Ӧ����Խ�죬����ͼ���֪ǰ5min�ڼס��ҡ������������з�Ӧ��ƽ�����ʣ�v (A)��<v(A)��<v(A)����B������C�����൱���ڼĻ����������¶ȣ�ƽ�����淴Ӧ������У�A��ת���ʽ��ͣ�����1molA����1molC������4molA����4molC������A��ת������ȣ�C������D������C�з����Һͱ��ǵ�Ч�ģ���Ӧǰ��������䣬���x��1������ƽ��ʱC��Ũ����1.0mol/L������ݷ���ʽ��֪������A��Ũ����0.5mol/L��ƽ��ʱA��Ũ����0.5mol/L��B��Ũ����1.5mol/L����T2��ʱ�÷�Ӧ��ƽ�ⳣ��ΪK��![]() ��D��ȷ����ѡD��
��D��ȷ����ѡD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ������˵����ȷ���ǣ� ��
A. ���³�ѹ�£�56 g��ϩ�ͱ�ϩ�Ļ�����к��е�̼ԭ����Ϊ4NA
B. 1.2 g NaHSO4�����к��е������Ӻ������ӵ�����Ϊ0.03NA
C. 12 g���ʯ�к��еĹ��ۼ���Ϊ4NA
D. 1 mol Fe2����������H2O2��Һ��Ӧ��ת��2NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A. ��״���£�11.2LSO2�����к���ԭ��������18gˮ�к��е���ԭ����
B. 5.6 g��������ϡ���ᷴӦʧȥ�ĵ��ӵ����ʵ���Ϊ0.3 mol
C. 100g98%��Ũ������������ԭ�Ӹ���Ϊ4mol
D. 20gNaOH����1Lˮ��������Һ��c(Na+)=0.5mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���廯�ƿ�������ȼ���������,����������ˮ,������������.ʵ�����ù�ҵ����ʯ(��������Al3+��Fe3+������)�Ʊ��廯�Ƶ���Ҫ��������:

���������ϣ���HBr(�����ᣩΪһԪǿ�
��Al3+��Fe3+��pH=8ʱ��ȫת��Ϊ������
��VΪIV���˺����Һ��
(1)д��I�ܽ�����ӷ���ʽ��_________________________________________��
(2)����ʹ�õ����������������Ϊ26��,����47���������ᣨ�ܶ�Ϊ1.49g/cm������26����������500 mL,����IJ��������в���������ͷ�ι���___________��
(3)��֪����������Һ�в���NH4+.������������Լ�a��_____________���ѧʽ����
A.NaOH B. Ba(OH)2 C. NH3��H2O D. Ca(OH)2
(4)�����������IJ���������__________________��__________________��������
(5)�Ƶõ��廯�ƿ���ͨ�����²���ⶨ�䴿��:
�ٳ�ȡ4.00g��ˮ�廯����Ʒ;���ܽ�;�۵�������Na2CO3��Һ,��ַ�Ӧ�����;�ܺ�ɣ���ȴ���ݳ���.���õ�1.88g̼���,���廯�Ƶ���������Ϊ_________________ (������λС��),��ʵ������淶���ⶨ���ƫ��,��ԭ����_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ƿ���PtCl2(NH3)2�����ֲ�ͬ���ʵ��칹�壬�������±�����ش���������:
����� | ��ɫ | ��ˮ�е��ܽ� | �������� |
PtCl2(NH3)2 | ����ɫ | 0.2577g/100gH2O | �л��� |
PtCl2(NH3)2 | ����ɫ | 0.0360g/100gH2O | ���� |
��1��PtCl2(NH3)2�Ŀռ�ṹ��______________��
��2���������ǵ����ʷ���������ɫ������________________������Է��ӡ��Ǽ��Է��ӡ�����
��3���뻭������ɫ������ӵļ��ι���ͼ��__________________��
��4������ɫ������ˮ���ܽ�Ƚϴ��ԭ����____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ�������й���Һ���������ʵ���Ũ�ȹ�ϵ��ȷ����
A. 0.1 mol��L��1 (NH4)2Fe(SO4)2��Һ�У�c(SO42��)��c(NH4+)��c(Fe2+)��c(H+)
B. pH��11�İ�ˮ��pH��3��������Һ�������ϣ�������Һ�У�c(Cl��)��c(NH4+)��c(OH��)��c(H+)
C. ��0.1 mol��L��1 Na2CO3��Һ����2c(Na+)��c(CO![]() )��c(HCO
)��c(HCO![]() )��c(H2CO3)
)��c(H2CO3)
D. 0.1 mol��L��1�Ĵ�������Һ20 mL��0.1 mol��L��1����10 mL��Ϻ���Һ��������c(CH3COO��)��c(Cl��)��c(CH3COOH)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԭ����ܷ�ӦΪ:Cu+2Fe3+==Cu2++2Fe2+��������ʵ�ָ÷�Ӧ��ԭ�����
A | B | C | D | |
�缫���� | Cu��C | Cu��Ag | Cu��Zn | Fe��Zn |
�������Һ | Fe(NO3)3 | FeSO4 | FeCl3 | CuSO4 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO������(N2H4)�����ʼ�Ӧ�õ��о�����Դ������������������Ҫ���⡣
(1)����CO��O2��KOH��Һ�����Ƴɼ���ȼ�ϵ�أ���õ�ط�Ӧ�����ӷ���ʽΪ________________��
����CO��O2�������ʻ������Ƴ�����ͼ1��ʾ��ȼ�ϵ�أ���缫d�ĵ缫��ӦʽΪ______________��
(2)���������������ڰ�����������ͨ��CuO��Һ�У��й����ʵ�ת����ͼ2��ʾ��
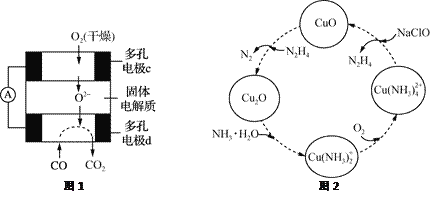
����ͼʾ2��ת���У����ϼ۲����Ԫ����_________(��Ԫ������)��
����ת��������ͨ������������Ӧ����Һ��pH��________(����������������С������������)��ת���е���1 mol N2H4���뷴Ӧʱ����Ҫ����O2�����ʵ���Ϊ________��
������NaClOʱ�����ķ�ӦΪ��Cu(NH3)![]() ��2ClO����2OH����Cu(OH)2����2N2H4����2Cl����2H2O
��2ClO����2OH����Cu(OH)2����2N2H4����2Cl����2H2O
�÷�Ӧ����80�����Ͻ��У���Ŀ�ij��˼ӿ췴Ӧ�����⣬����________��________
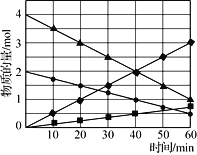
ͼ3
(3)CO��SO2����������������773 K�����·�Ӧ����CO2�����������÷�Ӧ�����ڴ��̵����л�����Ӧ��ϵ�и���ֵ����ʵ����뷴Ӧʱ��Ĺ�ϵ��ͼ3��ʾ��д���÷�Ӧ�Ļ�ѧ����ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ���ǣ� ��
A. 9.2g NO2��N2O4�Ļ�����к���ԭ����ĿΪ0.2NA
B. ���³�ѹ�£�35.5gCl2��������NaOH��Һ��ȫ��Ӧ��ת�Ƶĵ�����Ϊ0.5NA
C. ��״���£�2.24LNH3��1.6gCH4����������������Ŀ��ΪNA
D. ��֪��ӦN2(g)+3H2(g)![]() 2NH3(g) ��H=-92.4kJ��mol-1��������NA��NH3����ʱ����Ӧ�ų�������С��46.2kJ
2NH3(g) ��H=-92.4kJ��mol-1��������NA��NH3����ʱ����Ӧ�ų�������С��46.2kJ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com