
【题目】溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质.实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:

经查阅资料:①HBr(氢溴酸)为一元强酸;
②Al3+、Fe3+在pH=8时完全转化为沉淀。
③V为IV过滤后的溶液。
(1)写出I溶解的离子方程式:_________________________________________。
(2)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸(密度为1.49g/cm)配置26%的氢溴酸500 mL,所需的玻璃仪器有玻璃棒、胶头滴管、___________。
(3)已知步骤Ⅲ的滤液中不含NH4+.步骤Ⅱ加入的试剂a是_____________(填化学式)。
A.NaOH B. Ba(OH)2 C. NH3·H2O D. Ca(OH)2
(4)步骤Ⅴ所含的操作依次是__________________、__________________、过滤。
(5)制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④烘干,冷却。⑤称量.若得到1.88g碳酸钙,则溴化钙的质量分数为_________________ (保留两位小数),若实验操作规范而测定结果偏低,其原因是_____________________。
【答案】 CaCO3+2H+ =Ca2+ +CO2↑+H2O 量筒 烧杯 D 蒸发浓缩 冷却结晶 94% 溴化钙吸水
【解析】(1)氢溴酸为强酸,写出与碳酸钙反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(2)用浓溶液配制500mL稀溶液,因此需要量筒取经过计算需要的浓溶液的体积,然后在烧杯中溶解、配制500mL溶液,故答案为:量筒;烧杯;
(3)加入的试剂a、控制溶液的pH以达到除去杂质Al3+、Fe3+的目的、防止氢氧化铝溶解的目的,因此a是碱,根据题意及不引入新的杂质可知是氢氧化钙,故选D;
(4)步骤Ⅴ的结果从溶液中得到CaBr26H2O,因此其操作步骤为蒸发浓缩,冷却结晶、过滤,故答案为:蒸发浓缩,冷却结晶;
(5)CaBr2~CaCO3
200 100
3.76g 1.88g
故CaBr2的质量为3.76g,质量分数为=![]() ×100%=94%;溴化钙易吸水,因此造成测定结果偏低,故答案为:94%;溴化钙吸水。
×100%=94%;溴化钙易吸水,因此造成测定结果偏低,故答案为:94%;溴化钙吸水。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】砷(As)是广泛分布于自然界的非金属元素,其化合物用于制造农药、防腐剂等。已知 它位于第四周期,与 N 同主族。关于砷的说法中不正确的是( )
A. 原子序数为 33
B. 稳定性:AsH3 > NH3
C. 与 Se 单质相比,As 更难与氢气化合
D. 半径:砷原子>磷原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。A的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是_____ (填元素符号),e的价层电子排布图为__________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ________ ;分子中既含有极性共价键、又含有非极性共价键的化合物是__________(填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是___;酸根呈三角锥结构的酸是 _____________ 。(填化学式)
(4)e和c形成的一种离子化合物的晶体结构如图1,则e离子的电荷为__________。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。

该化合物中阴离子为 ______ ,阳离子中存在的化学键类型有_____________ ;该化合物加热时首先失去的组分是________ ,判断理由是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图为五个椭圆交叉构成的图案,其中五个椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3、KOH五种物质,图中相连的物质均可归为一类,相交部分A、B、C、D为相应的分类标准代号
![]()
①相连的两种物质都是电解质的是________________(填分类标准代号,下同)都是氧化物的是__________________
②图中相连的两种物质能够相互反应的是_________________________,所属基本反应类型的是______________________反应。
③上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,则该反应的离子方程式为_______________________________________________________
④用洁净的烧杯取25 ml 蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热至液体呈红褐色,得到的分散系称为___________________,证明该分散系生成的实验原理是_________________________________________。
(2)分类方法应用比较广泛,属于同一类的物质具有相似性,在生活和学习中使用分类的方法处理问题,可以做到举一反三,还可以做到由此及彼。如:
①CO2、SiO2、SO2、SO3都属于酸性氧化物,由CO2+Ca(OH)2=CaCO3↓+H20,可完成SO3与NaOH反应的离子方程为______________________________________。
②NaHCO3、NaHSO3、NaHS都属于弱酸形成的酸式盐,NaHCO3+HCl==NaCl+H20+CO2↑及NaHCO3+NaOH==Na2CO3+H20,可完成NaHS分别与HCl、NaOH反应的离子方程式为________________________________、________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图与对应的反应情况正确的是( )
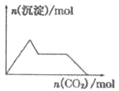
A. 含0.0l mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2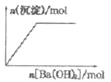
B. NaHSO4溶液中逐滴加入Ba(OH)2溶液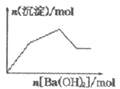
C. KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液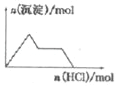
D. NaAlO2溶液中逐滴加入盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的用途正确的是( )
A.FeCl3可用作补血剂B.小苏打可用作供氧剂
C.CuSO45H20可检验水蒸气的存在D.含NaClO的漂白液可用于杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。
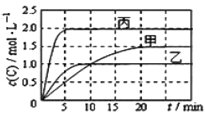
容器 | 甲 | 乙 | 丙 |
容积 | 1L | 1L | 2L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
下列说法正确的是( )
A. 由图可知Tl<T2,且正反应为吸热反应
B. 前5min内甲、乙、丙三个容器中反应的平均速率:v (A)乙<v(A)甲<v(A)丙
C. 平衡时A的转化率a : a乙<a甲<a丙
D. T2时该反应的平衡常数K=1.33
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某固定体积的绝热密闭容器中进行的可逆反应A (g)+B(g)![]() C(s)+2D(g),可以说明己达到平衡状态的是( )
C(s)+2D(g),可以说明己达到平衡状态的是( )
①反应容器中压强不随时间变化而变化;②A气体和B气体的生成速率相等;③混合气体的平均摩尔质量不随时间变化而变化;④混合气体的密度不随时间变化而变化⑤化学平衡常数不变
A. ①④⑤ B. ③④ C. ①③④⑤ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为 ( )
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com