
【题目】
人类社会的发展与进步与材料的发展密不可分,而金属是人类常用的一类材料如铜、铁合金等等。
(1)基态Cu原子的价电子排布式为__________,在元素周期表中的位置为___________。
(2)Cu2O为半导体材料,可由乙醛(CH3CHO)和新制氢氧化铜反应得到。乙醛中碳原子的杂化方式有______________,乙醛分子中![]() 键与
键与![]() 键的数目之比为____________。
键的数目之比为____________。
(3)制造单晶硅太阳能电池片时,一般掺杂微量的铜、碳、硼、氮等。铜、碳、硼、氮元素的电负性由大到小的顺序是_________________。(用元素符号表示)
(4)Cu(OH)2溶于氨水形成深蓝色的[Cu(NH3)4]2+,该配合物中NH3的价层电子对互斥模型为_____________。
(5)铁在不同温度范围有不同的晶体结构,在室温下为体心立方,当温度升高到912℃,则转变为面心立方。铁的体心立方堆积和面心立方最密堆积的配位数分别为____、_____。若铁原子半径为r pm,则铁为面心立方最密堆积时的晶体密度为___________g/cm3(阿伏伽德罗常数的值用NA 表示,1pm=10-12m,写出计算式即可)。

面心立方晶胞
【答案】 3d104s1 第四周期第IB族 sp3、sp2 6:1 N>C>B>Cu 四面体形 8 12 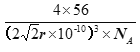
【解析】(1)Cu为29号,基态Cu原子价电子排布式为:3d104s1;在元素周期表中的位置为第四周期第IB族。
(2)乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化;1个乙醛分子含有6个σ键和一个π键,则σ键和π键数目之比为6:1。
(3)同周期元素的电负性随原子序数增大而增大,同主族元素的电负性随原子序数增大而减小,故电负性N>C>B,元素的电负性越大,表示其原子在化合物中吸引电子的能力越强,因此非金属元素B的电负性应大于金属元素Cu,故电负性N>C>B>Cu。
(4)[Cu(NH3)4]2+离子中,Cu2+给出空轨道,NH3提供孤对电子,Cu2+与NH3之间形成配位键,单独看NH3应该是三角锥形,在该配合物中看应该为四面体形。
(5)所谓配位数指任一原子周围最近邻且等距离的原子数;如图: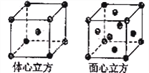 ,对于体心立方晶体,离中心原子最近的原子有8个;对于面心立方晶体,任取其中一个原子为原点作x、y、z三个平面,构成空间直角坐标系,那么,在每一个平面中,都有四个配位原子在其左上、左下、右上、右下。三个平面共12个,所以铁的体心立方堆积和面心立方最密堆积的配位数分别为8、12。面心立方最密堆积晶胞原子数为:8×
,对于体心立方晶体,离中心原子最近的原子有8个;对于面心立方晶体,任取其中一个原子为原点作x、y、z三个平面,构成空间直角坐标系,那么,在每一个平面中,都有四个配位原子在其左上、左下、右上、右下。三个平面共12个,所以铁的体心立方堆积和面心立方最密堆积的配位数分别为8、12。面心立方最密堆积晶胞原子数为:8×![]() +6×
+6×![]() =4,所以晶胞质量为:
=4,所以晶胞质量为:![]() g,1pm=10-12m=10-10cm由晶胞切面图
g,1pm=10-12m=10-10cm由晶胞切面图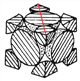 可得:面对角线长为4r pm,所以晶胞棱长为
可得:面对角线长为4r pm,所以晶胞棱长为![]() r pm,1pm=10-12m=10-10cm,则体积为:
r pm,1pm=10-12m=10-10cm,则体积为:![]() cm3,所以密度为
cm3,所以密度为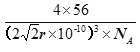 g/cm3。
g/cm3。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.下图为实验室蒸馏自来水得到少量蒸馏水的装置示意图,请根据图示回答下列问题:

(1)装置中仪器A的名称是___________,仪器B 的名称是_____________。
(2)请指出上图中的三处明显错误中的两处:__________、__________。
Ⅱ.选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.蒸馏 B.过滤 C.结晶 D.分液
(1)分离水和煤油的混合物__________。
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾__________。
(3)从加热氯酸钾制氧气后的剩余固体中获得MnO2。溶解、__________。
(4)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠(NaCN)是一种重要的化工原料,用于电镀、冶金和有机合成医药,农药及金属处理等方面。
已知:氰化钠为白色结晶颗粒或粉末,易潮解,有微弱的苦杏仁气味,剧毒。熔点563.7℃,沸点1496℃。易溶于水,易水解生成氰化氢,水溶液呈强碱性。
(1)氰化钠中氮元素的化合价是______,用离子方程式表示NaCN溶液呈强碱性的原因:________。
(2)已知:
物质 | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=6.2×10-10 | Ka1=4.5×10-7,Ka2=4.7×10-11, |
则向NaCN溶液通入少量CO2反应的离子方程式:_______________。
(3)用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法错误的是________________。

A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O
C.阴极的电极反应式为:2H2O+2e- =H2↑+2OH-
D.除去CN-的反应:2CN-+5ClO-+2H+ =N2↑+2CO2↑+5Cl-+H2O
(4)氰化钠可用双氧水进行消毒处理。
用双氧水处理氰化钠产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式____________;
(5)过碳酸钠(2Na2CO3·3H2O2)具有Na2CO3和H2O2的双重性质,也可用于含氰废水的消毒处理。
① 下列物质中,不会引起过碳酸钠发生氧化还原反应的有___________。
A. FeC13 B. CuSO4 C. Na2SiO3 D. KCN
② 已知 6KMnO4 + 5(2Na2CO3·3H2O2)+19H2SO4=3K2SO4+6MnSO4+10Na2SO4+10CO2↑+15O2↑+34H2O.现称取0.2000g 过碳酸钠样品于250mL 锥形瓶中,加50mL蒸溜水溶解,再加50mL 2.0000molL-1H2SO4,用0.0200 molL-1 KMnO4标准溶液滴定至终点时消耗30.00mL,则产品中H2O2的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硝酸氧化淀粉水解的产物(C6H12O6)可以制备草酸,装置如下图所示(加热、搅拌和仪器固定装置均己略去)。

实验过程如下:
①将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30 min,得到淀粉水解液,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后得草酸晶体粗品,再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入少许98%硫酸的目的是:_____________________。
(2)冷凝水的进口是________(填a或b);实验中若混酸滴加过快,将导致草酸产量下降,其原因是______________________。
(3)装置B的作用是___________,为使尾气被充分吸收,C中的试剂是___________。
(4)重结晶时,将草酸晶体粗品经I加热溶解、Ⅱ趁热过滤、Ⅲ冷却结晶、Ⅳ过滤洗涤、Ⅴ干燥等实验步骤,得到较纯净的草酸晶体。该过程中可将粗品中溶解度较大的杂质在_________(填上述实验步骤序号)时除去;而粗品中溶解度较小的杂质最后留在_______(填“滤纸上”或“滤液中”)。
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。称取一定量该样品加适量水完全溶解,用KMnO4标准液滴定,反应的离子方程式为_________________。 滴定前后滴定管中的液面读数如图所示,则消耗KMnO4溶液的体积为_________。

(6)已知草酸是一种二元弱酸,草酸氢钠溶液(NaHC2O4)显酸性。常温下,向10 mL0.01 mol L -1IH2C2O4溶液中加入10mL0.01mol·L-1NaOH溶液时,溶液中各种离子的浓度由大到小的顺序为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
尼龙是世界上出现的第一种合成纤维。尼龙的出现使纺织品的面貌焕然一新,它的合成是合成纤维工业的重大突破,同时也是高分子化学的一个重要里程碑。下图是以1,3—丁二烯为原料来合成尼龙66的路线:

已知:

③A存在顺反异构
根据以上信息回答下列问题:
(1)下列关于有机高分子化合物的说法正确的是________。
A.有机高分子化合物均可水解为小分子
B.淀粉和纤维素的分子式均为(C6H10O5)n,它们互为同分异构体
C.蛋白质的盐析过程是物理变化
D.因蛋白质在高温下易变性,所以疫苗保存时需冷藏
(2)有机物A的结构简式为_______________,A→B的反应类型为___________。
(3)D中所含官能团的名称为_______________________。
(4)写出C+E→F的化学方程式______________。
(5)与E官能团相同的同分异构体有______种(不包括E),写出其中核磁共振氢谱有4组吸收峰且峰面积之比为2:4:1:3的结构简式________________。
(6)已知:

以CH2=CH2为原料,其他无机试剂任选合成 
结合本题信息写出合成路线_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,欲测定Na2O2试样的纯度。可供选用的反应物只有CaCO3固体、6mol·L-1硫酸、6mol·L-1盐酸和蒸馏水。已知:①浓硫酸有吸水性、脱水性和强氧化性,②碱石灰的成分为CaO和NaOH。实验方案为:①制备并提纯CO2。②将纯净的CO2通过试样。③测定生成O2的体积。④根据O2的体积计算Na2O2试样的纯度。实验装置如下:

回答下列问题:
(1)装置A中发生反应的离子方程式是______________________________________。
(2)装置B的作用是_______________________,装置C的作用是_______。
(3)装置E的作用是__________________________________________
(4)装置D中发生反应的化学方程式是______________________________________。
(5)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com