
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 1 mol/L NaCl溶液中含有的钠离子数为NA
B. 1molN2与4molH2在密闭容器中充分反应生成的NH3分子数为2NA
C. 将含0.1molFeCl3的饱和溶液滴入沸水形成的胶体粒子的数目小于0.1 NA
D. 10 g 46%的CH3CH2OH的水溶液中含氢原子数目为0.6NA
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol·L-1NaOH溶液滴定新配制的25.0mL0.02 mol·L-1FeSO4溶液,应用手持技术测定溶液的pH与时间(t)的关系,结果如右图所示。下列说法错误的是
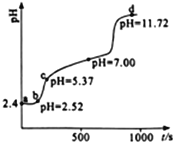
A. ab段,溶液中发生的主要反应:H++OH-=H2O
B. bc段,溶液中c(Fe2+) > (Fe3+) >c(H+)>c(OH-)
C. d点,溶液中的离子主要有Na+、SO42-、OH-
D. 滴定过程发生了复分解反应和氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺最早被李比希于1834年合成,它有毒,不可用于食品加工或食品添加剂。经李比希法分析得知,三聚氰胺分子中,氮元素的含量高达66.67%,氢元素的质量分数为4.76%,其余为碳元素。它的相对分子质量大于100,但小于150。试回答下列问题:
(1)分子式中原子个数比N(C)∶N (H)∶N(N)=________________________。
(2)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳氮两种元素组成的六元杂环。则三聚氰胺的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1)基态氮原子最高能级上电子的自旋方向有________种,硒原子的电子排布式为[Ar]_____。
(2)铁的一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于________(填晶体类型)。
(3)与BF3互为等电子体的分子和离子分别为______(各举1例);已知分子中的大π键可用符号Ⅱnm表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Ⅱ66),则BF3中的大π键应表示为________。
(4)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为_______(填字母)。

(5)砷化硼(BAs)晶体结构与金刚石相似,则:
①BAs晶体中,As的杂化形式为_________.
②已知B原子的电负性比As原子的电负性大,则As与B之间存在的化学键有______(填字母)。
A.离子键 B.金属键 C.极性键 D.氢键 E.配位键 F.σ键 G.π键
③BAs晶体的晶胞参数为bpm,则其晶体的密度为______(列出表达式,设NA为阿伏加德罗常数的数值)g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A. 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B. 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4FeOH)3(s)能自发进行,则△H<0
C. NH4Al(SO4)2溶液中加入少量氢氧化钠溶液:NH4++OH-=NH3·H2O
D. 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对C2H6和C5H12的分析错误的是( )
A. 互为同系物
B. C2H6失去1个H得到的乙基只有一种结构
C. C5H12的一氯代物可能只有一种
D. 2,2-二甲基丙烷的沸点高于其同分异构体的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①大气固氮;②硝酸银分解;③实验室制取氨气等变化中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
A.①②③B.②①③C.③②①D.③①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用480mL、0.5mol/L 的稀硫酸,某同学用98%的浓硫酸(ρ=1.84g/cm3) 进行配制,请回答下列问题:
(1) 实验需要的玻璃仪器除了烧杯,胶头滴管、量简、玻璃棒,还需要__________;
(2)计算: 需用量筒量取浓硫酸的体积为__________ mL;
(3) 配制过程:
①用量筒量取所需的浓硫酸
②将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌,冷却至室温
③用玻璃棒引流将烧杯中的溶液转移到已经检漏的合适规格的容量瓶中
④洗涤烧杯和玻璃棒2~3 次,洗涤液也注入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀
⑤向容量流中加入蒸馏水,在距离刻度1~2cm 时,然后定容
⑥盖好瓶塞,反复上下颠倒,摇匀;
⑦将配制好的溶液转移至试剂瓶中待用。
上述步骤中一定用到胶头滴管的有__________(填序号);
若步骤⑤定容时加水超过刻度线,应该如何处置:___________。
(4) 在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”).
①所用的浓硫酸长时间放置在密封不好的容器中______;
②用量简量取浓硫酸时仰视液面______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com