
【题目】下列关于化学键的说法正确的( )
A.只存在于分子之间
B.相邻原子间强烈的相互作用
C.只存在于离子之间、
D.相邻分子间的相互作用
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,欲测定Na2O2试样的纯度。可供选用的反应物只有CaCO3固体、6mol·L-1硫酸、6mol·L-1盐酸和蒸馏水。已知:①浓硫酸有吸水性、脱水性和强氧化性,②碱石灰的成分为CaO和NaOH。实验方案为:①制备并提纯CO2。②将纯净的CO2通过试样。③测定生成O2的体积。④根据O2的体积计算Na2O2试样的纯度。实验装置如下:

回答下列问题:
(1)装置A中发生反应的离子方程式是______________________________________。
(2)装置B的作用是_______________________,装置C的作用是_______。
(3)装置E的作用是__________________________________________
(4)装置D中发生反应的化学方程式是______________________________________。
(5)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年我国首次海域可燃冰(甲烷的结晶水合物)试采成功。关于甲烷的结构与性质说法正确的是( )
A.是平面正方形分子B.能与强酸、强碱反应
C.能与氯气在光照条件下反应D.能使高锰酸钾酸性溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 1 mol/L NaCl溶液中含有的钠离子数为NA
B. 1molN2与4molH2在密闭容器中充分反应生成的NH3分子数为2NA
C. 将含0.1molFeCl3的饱和溶液滴入沸水形成的胶体粒子的数目小于0.1 NA
D. 10 g 46%的CH3CH2OH的水溶液中含氢原子数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中①NaCl晶体 ②液态S03 ③醋酸 ④汞 ⑤BaS04固体 ⑥酒精 ⑦熔化的KN03 属于电解质的是(填序号)_________________________
(2)质量为3.9 g的Na2X中含有Na+的物质的量为0.1mol,则Na2X的摩尔质量为______,
(3)某气体对氧气的相对密度为2,则此气体的相对分子质量为______
(4)3.01×1022个S2-的物质的量为________,质量为________,含有质子的物质的量为______,含有电子的物质的量为________。
(5)某地酸雨经检验,除含氢离子外,还有如下离子:c(Na+)=1.4×10-3 mol·L-1 ,c(Cl-) =3.5×10-3 mol·L-1 ,c(NH) =2.3×10-3 mol·L-1 , c(SO![]() ) =1.5×10-3 mol·L-1。则该溶液中氢离子的浓度为_____________ mol·L-1。
) =1.5×10-3 mol·L-1。则该溶液中氢离子的浓度为_____________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.核外电子排布完全相同的两种粒子,其化学性质一定相同
B.难失电子的原子,一定具有强氧化性
C.离子化合物和共价化合物中都可能含有非极性键
D.共价化合物溶水电离过程中,共价键未被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜锌原电池(稀硫酸作电解质溶液)的叙述错误的是( )
A.电子由正极通过导线流向负极
B.负极反应式为:Zn﹣2e﹣=Zn2+
C.正极产生1molH2电池转移2mol电子
D.可以用碳棒代替铜片作为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科大陈乾旺教授等人发明![]() 合成金刚石的新方法,化学原理为:①
合成金刚石的新方法,化学原理为:①![]() (未配平)该方法比1955年人工首次制得金刚石的旧方法容易得多。②
(未配平)该方法比1955年人工首次制得金刚石的旧方法容易得多。②![]() 。以下表述正确的是( )
。以下表述正确的是( )
A. 反应①中既有旧化学键的断裂又有新化学键的形成
B. 新方法利用的是物理变化,旧方法利用的是化学变化
C. 在反应①中每生成![]() 金刚石需要消耗
金刚石需要消耗![]() 金属钠
金属钠
D. 反应①和反应②中所得的金刚石都是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组在实验室利用直接合成法制各甘氨酸亚铁。有关物质性质如下所示:
甘氨酸( NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇、 | 易溶于水和乙醇, | 易溶于水, |
两性化合物 | 有强酸性和还原性 | 难溶于乙醇 |
实验过程及装置图如下(夹持和加热仪器已省略):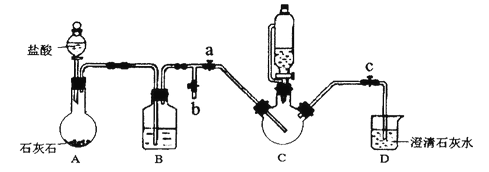
I.合成:在C中加入0.10mol甘氨酸、0.05mol硫酸亚铁、少量柠檬酸和200mL水,利用CO2将C装置中的空气排净,然后在40℃恒温条件下用磁力搅拌器不断搅拌,并用恒压滴液漏斗向C中滴加6mol·L-1NaOH溶液调节pH到6左右,使反应物充分反应。
II.分离:加入无水乙醇,立即出现白色沉淀。将沉淀进行过滤、洗涤,收集滤渣。
Ⅲ.提纯:将滤渣溶解于适量的蒸馏水中,然后结晶、过滤,将纯化后的产品放入真空干燥箱中干燥后称重。
回答下列问题:
(1)B装置的作用是______________;
(2)能证明C装置中空气排净的现象是______________;向C中滴加NaOH溶液之前应该停止滴加盐酸,且关闭止水夹____________,打开止水夹________
(3)“合成”中加入柠檬酸的作用是______________:请写出合成甘氨酸亚铁的化学方程式_________。
(4)加入乙醇的目的是________;“提纯”时用的结晶方法为________________
(5)通过测量得知:等浓度(NH2CH2COO)2Fe 溶液导电能力远小于FeSO4溶液。暴露在空气中,(NH2CH2COO)2Fe溶液比FeSO4溶液难被氧化,请分析原因为________
(6)若产品质量为ag,则产率为________ %。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com