
【题目】(1)下列物质中①NaCl晶体 ②液态S03 ③醋酸 ④汞 ⑤BaS04固体 ⑥酒精 ⑦熔化的KN03 属于电解质的是(填序号)_________________________
(2)质量为3.9 g的Na2X中含有Na+的物质的量为0.1mol,则Na2X的摩尔质量为______,
(3)某气体对氧气的相对密度为2,则此气体的相对分子质量为______
(4)3.01×1022个S2-的物质的量为________,质量为________,含有质子的物质的量为______,含有电子的物质的量为________。
(5)某地酸雨经检验,除含氢离子外,还有如下离子:c(Na+)=1.4×10-3 mol·L-1 ,c(Cl-) =3.5×10-3 mol·L-1 ,c(NH) =2.3×10-3 mol·L-1 , c(SO![]() ) =1.5×10-3 mol·L-1。则该溶液中氢离子的浓度为_____________ mol·L-1。
) =1.5×10-3 mol·L-1。则该溶液中氢离子的浓度为_____________ mol·L-1。
【答案】① ③ ⑤ ⑦ 78g/mol 64 0.05mol 1.6g 0.8mol 0.9mol 2.8 ×10-3
【解析】
用电解质的概念去判断是否为电解质;依据质量和物质的量关系式,及阿伏加德罗定律推论去求摩尔质量和相对分子量,用溶液中离子电荷守恒,计算离子浓度。
(1).电解质是在溶液里或熔融状态下,可以导电的化合物。所以① ③ ⑤ ⑦是电解质。
(2).n(Na2X)=![]() n(Na+)=0.05mol,所以M(Na2X)=
n(Na+)=0.05mol,所以M(Na2X)=![]() =78g/mol。
=78g/mol。
(3).因为在相同的条件下,气体的密度之比等于相对分子量之比,所以此气体的相对分子质量为M=32![]() 2=64。
2=64。
(4).依据n=N/NA,求物质的量,n=m/M,求质量,硫原子质子数是16,S2-的电子数是18;所以3.01×1022个S2-的物质的量为0.05mol,质量为1.6g,含有质子的物质的量为0.8mol,含有电子的物质的量为0.9mol。
(5).因为溶液中阴、阳离子所带电荷是守恒的,所以有c(Na+)+c(NH)+c(H+)= c(Cl-)+2c(SO![]() ),解得c(H+)=2.8 ×10-3 mol·L-1。
),解得c(H+)=2.8 ×10-3 mol·L-1。


科目:高中化学 来源: 题型:
【题目】下列操作容易造成蔬菜中的维生素损失的是( )
A.洗菜:要先洗后切
B.浸泡:切好的菜要浸泡半天,以除去残留农药
C.切菜:要随切随炒,切忌切好后久置
D.烹饪:烹调蔬菜时适当加点醋,可以减少维生素C的损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A. 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B. 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4FeOH)3(s)能自发进行,则△H<0
C. NH4Al(SO4)2溶液中加入少量氢氧化钠溶液:NH4++OH-=NH3·H2O
D. 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL bmol·L-1的CH3COOH溶液中逐渐滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(CH3COO-)=c(Na+),下列说法正确的是( )
A. b<0.01
B. 混合后溶液酸碱性无法判断
C. CH3COOH的电离常数Ka=![]()
D. 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】惕格酸(C5H8O2,分子中有两个甲基)可用于制备香精,由烃A生成惕格酸的反应如下:
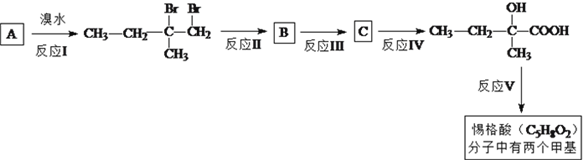
完成下列填空:
(1)写出反应类型。反应I:_____________反应、反应V:_______________反应。
(2)写出反应II试剂和反应条件:________________________________________。
(3)写出反应III的化学反应方程式:___________________________________________。
(4)如何检验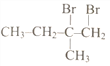 中的溴元素?____________________________________。
中的溴元素?____________________________________。
(5)写出符合下列条件的惕格酸的同分异构体的结构简式:_________________________。条件:与惕格酸含相同官能团,且也有两个甲基。 溴代甲基环己烷(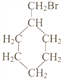 也可表示为
也可表示为![]() )可通过反应合成1-甲基环己烯(
)可通过反应合成1-甲基环己烯(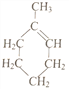 也可表示为
也可表示为![]() )
)
(6)设计一条以溴代甲基环己烷为原料合成1-甲基环己烯的合成路线。(合成路线常用的表示方式为: ![]() )________________
)________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1HCl溶液滴定20 mL 0.050 mol·L-1Na2CO3和0.025 mol·L-1NaHCO3混合溶液,得出如图所示的滴定曲线。下列说法不正确的是
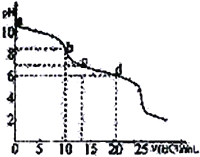
A. a点溶液显碱性的主要原因:CO32-+H2O![]() HCO3-+CH-
HCO3-+CH-
B. b点溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. c点溶液中:c(Na+)=c(HCO3-)+2c(CO32-)+ c(Cl-)
D. d点溶液中:c(Na+)> c(Cl-)> c(HCO3-)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com