
【题目】常温下,用0.10 mol·L-1HCl溶液滴定20 mL 0.050 mol·L-1Na2CO3和0.025 mol·L-1NaHCO3混合溶液,得出如图所示的滴定曲线。下列说法不正确的是
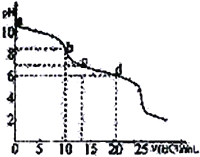
A. a点溶液显碱性的主要原因:CO32-+H2O![]() HCO3-+CH-
HCO3-+CH-
B. b点溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. c点溶液中:c(Na+)=c(HCO3-)+2c(CO32-)+ c(Cl-)
D. d点溶液中:c(Na+)> c(Cl-)> c(HCO3-)>c(H+)>c(OH-)
【答案】B
【解析】A. a点溶液0.050mol·L-1 Na2CO3和0.025 mol·L-1 NaHCO3混合溶液,Na2CO3和NaHCO3均能水解使溶液呈碱性,但主要原因是CO32-的水解,故A正确。B. b点加入10mL HCl溶液后,溶液中的溶质为NaHCO3和NaCl,故B错误。C.据电荷守恒可知: c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(Cl-)+ c(OH-),由于c点溶液显中性,c(H+)= c(OH-),所以c(Na+)=c(HCO3-)+2c(CO32-)+c(Cl-),故C正确。D. d点加入20mL 0.10mol·L-1HCl溶液后,溶液中c(NaCl)=0.050 mol·L-1,c(NaHCO3)=0.0125mol·L-1,所以c(Na+)>c(Cl-)>c(HCO3-),又因为d点pH<7,所以c(H+)>c(OH-),故D正确。故选B。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】(1)下列物质中①NaCl晶体 ②液态S03 ③醋酸 ④汞 ⑤BaS04固体 ⑥酒精 ⑦熔化的KN03 属于电解质的是(填序号)_________________________
(2)质量为3.9 g的Na2X中含有Na+的物质的量为0.1mol,则Na2X的摩尔质量为______,
(3)某气体对氧气的相对密度为2,则此气体的相对分子质量为______
(4)3.01×1022个S2-的物质的量为________,质量为________,含有质子的物质的量为______,含有电子的物质的量为________。
(5)某地酸雨经检验,除含氢离子外,还有如下离子:c(Na+)=1.4×10-3 mol·L-1 ,c(Cl-) =3.5×10-3 mol·L-1 ,c(NH) =2.3×10-3 mol·L-1 , c(SO![]() ) =1.5×10-3 mol·L-1。则该溶液中氢离子的浓度为_____________ mol·L-1。
) =1.5×10-3 mol·L-1。则该溶液中氢离子的浓度为_____________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】借助下表提供的信息,实验室制备乙酸丁酯所采取的措施正确的是
物质 | 乙酸 | 1-丁醇 | 乙酸丁酯 |
沸点 | 117.9℃ | 117.2℃ | 126.3℃ |
A. 采用水浴加热 B. 使用浓硫酸做催化剂
C. 用NaOH(aq)洗涤产物后分液 D. 边制备边蒸出乙酸丁酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中含有的可溶性杂质CaCl2、MgCl2和Na2SO4,需进行下列实验操作,请在()中填写所使用除杂试剂的化学式_____、____、_____、_____、_____,在![]() 中填写实验操作名称_____、_____、_____。
中填写实验操作名称_____、_____、_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组在实验室利用直接合成法制各甘氨酸亚铁。有关物质性质如下所示:
甘氨酸( NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇、 | 易溶于水和乙醇, | 易溶于水, |
两性化合物 | 有强酸性和还原性 | 难溶于乙醇 |
实验过程及装置图如下(夹持和加热仪器已省略):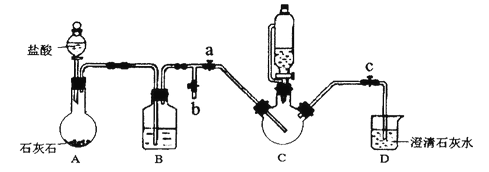
I.合成:在C中加入0.10mol甘氨酸、0.05mol硫酸亚铁、少量柠檬酸和200mL水,利用CO2将C装置中的空气排净,然后在40℃恒温条件下用磁力搅拌器不断搅拌,并用恒压滴液漏斗向C中滴加6mol·L-1NaOH溶液调节pH到6左右,使反应物充分反应。
II.分离:加入无水乙醇,立即出现白色沉淀。将沉淀进行过滤、洗涤,收集滤渣。
Ⅲ.提纯:将滤渣溶解于适量的蒸馏水中,然后结晶、过滤,将纯化后的产品放入真空干燥箱中干燥后称重。
回答下列问题:
(1)B装置的作用是______________;
(2)能证明C装置中空气排净的现象是______________;向C中滴加NaOH溶液之前应该停止滴加盐酸,且关闭止水夹____________,打开止水夹________
(3)“合成”中加入柠檬酸的作用是______________:请写出合成甘氨酸亚铁的化学方程式_________。
(4)加入乙醇的目的是________;“提纯”时用的结晶方法为________________
(5)通过测量得知:等浓度(NH2CH2COO)2Fe 溶液导电能力远小于FeSO4溶液。暴露在空气中,(NH2CH2COO)2Fe溶液比FeSO4溶液难被氧化,请分析原因为________
(6)若产品质量为ag,则产率为________ %。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质的电离方程式如下:
HClO4=H++ClO4-;
Ba(OH)2=Ba2++2OH-;
Fe2(SO4)3=2Fe3++3SO42-;
KHSO4=K++H++SO42-
属于酸的物质是__________(写化学式);属于碱的物质是__________;属于盐的物质是______________。
(2)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
①从物质的分类角度看,不恰当的一种物质是________________________________。
②上述物质中既不是电解质也不是非电解质的是_________________
③写出纯碱的电离方程式:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苄丙酮香豆素(H)常用于防治血觑栓栓塞性疾病。其合成路线如图所示(部分反应条件略去。)
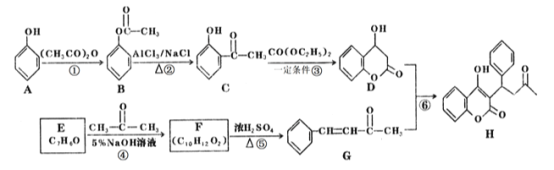
(1)E的名称是_________,D中含氧官能团的名称是_________。
(2)反应①的反应类型是__________,反应⑤的反应类型是_________。
(3)1mol H与H2加成,最多可消耗_____mol H2。
(4)反应③的化学方程式为____________________________________。
(5)C的同分异构体中满足下列条件的有______种,其中核磁共振氢谱有4组峰且峰面积之比为1:2:2:3的结构简式为__________(写一种即可)。
①不能和FeCl3溶液发生显色反应 ②1mol该有机物能与2molNaOH恰好完全反应
(6)参照苄丙酮香豆素的合成路线,设计一种以E和乙醛为原料制备![]() 的合成路线________。
的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一种或几种组成,为了探究它的成份,进行了如下实验:下列判断正确的是
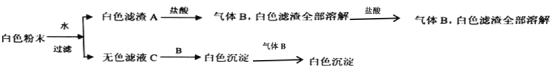
A. K2SO4、CuSO4一定不存在
B. BaCl2一定不存在
C. K2SO4、CaCO3、BaCl2一定存在
D. 滤液C中只含有BaCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com