
【题目】为了除去粗盐中含有的可溶性杂质CaCl2、MgCl2和Na2SO4,需进行下列实验操作,请在()中填写所使用除杂试剂的化学式_____、____、_____、_____、_____,在![]() 中填写实验操作名称_____、_____、_____。
中填写实验操作名称_____、_____、_____。

【答案】H2O 溶解 NaOH BaCl2 Na2CO3 过滤 HCl 蒸发
【解析】
除去粗盐中的可溶性杂质: CaCl2、MgCl2和Na2SO4的方法:(1)加水使粗盐溶解;(2)加入过量NaOH除去镁离子Mg2++2OH-=Mg(OH)2↓;(3)加入过量BaCl2除去硫酸根离子SO42-+Ba2+= BaSO4↓; (4)加入过量Na2CO3除去钙离子和过量的钡离子:CO32-+Ba2+= BaCO3↓、Ca2++CO32-=CaCO3↓; (5)过滤将沉淀和溶液分离; (6)加过量的盐酸除去多余的碳酸根离子、氢氧根离子;(7)蒸发,让多余的盐酸以氯化氢的形式挥发出去;因此,本题正确答案是: H2O、溶解 、 NaOH 、 BaCl2、Na2CO3 、 过滤 、 HCl、蒸发。


科目:高中化学 来源: 题型:
【题目】常温下,向10mL bmol·L-1的CH3COOH溶液中逐渐滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(CH3COO-)=c(Na+),下列说法正确的是( )
A. b<0.01
B. 混合后溶液酸碱性无法判断
C. CH3COOH的电离常数Ka=![]()
D. 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素CO(NH2)2,原理如图。下列有关说法正确的是( )
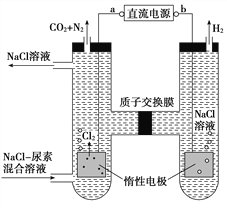
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 阳极室中发生的电极反应为2H++2e-=H2↑
D. 若两极共收集到气体产品13.44 L(标准状况),则除去的尿素为7.2 g(忽略气体的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下反应中,①铁丝在氧气中燃烧 ②加热碳和氧化铜的混合物③碳酸钠和硫酸反应 ④加热高锰酸钾固体 ⑤锌和稀硫酸反应 ⑥硫酸钠溶液和氯化钡溶液混合。属于离子反应的有___________(填各反应的序号,下同),属于氧化还原反应的___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、(1)惰性电极电解硫酸铜溶液的化学方程式_____________________________。
(2)惰性电极电解饱和食盐水的化学方程式_____________________________。
Ⅱ、某小组同学认为,如果模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
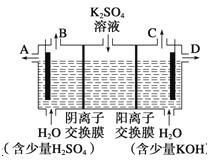
(3)该电解槽的阳极反应式为________________________________。此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(4)制得的氢氧化钾溶液从出口________(填写“A”、“B”、“C”或“D”)导出。
(5)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的反应式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1HCl溶液滴定20 mL 0.050 mol·L-1Na2CO3和0.025 mol·L-1NaHCO3混合溶液,得出如图所示的滴定曲线。下列说法不正确的是
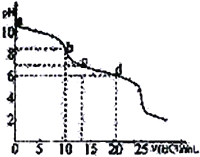
A. a点溶液显碱性的主要原因:CO32-+H2O![]() HCO3-+CH-
HCO3-+CH-
B. b点溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. c点溶液中:c(Na+)=c(HCO3-)+2c(CO32-)+ c(Cl-)
D. d点溶液中:c(Na+)> c(Cl-)> c(HCO3-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N、S、Cl元素可形成多种物质,在工业生产上有着广泛的应用。回答下列问题:
(1)Fe3+可与SCN-形成多种配离子,其中一种为[Fe(SCN)6]3-,该配离子中的SCN-会使铁的剩余价电子压缩配对,则每个配离子中铁的单电子个数为_______个。
(2)Se与S是同族元素,请写出基态Se原子电子排布式______。N与S是不同族元素,请解释NH3比H2S在水中溶解度大的原因:__________________。
(3)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__________。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__________。
(4)已知S4O62-的结构为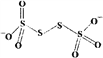 ,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
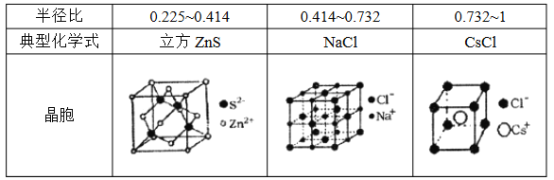
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为_________,晶体的密度为_________g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
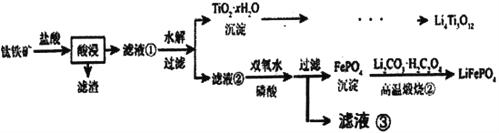
已知:“酸浸”后,钛主要以TiOCl42-形式存在
FeTiO3+4H++4C1-=Fe2++ TiOCl42-+2H2O
下列说法不正确的是
A. Li2Ti5O15中Ti的化合价为+4,其中有4个过氧键
B. 滤液②中的阳离子除了Fe2+和H+,还有Mg2+
C. 滤液②中也可以直接加适量的氯水代替双氧水
D. “高温煅烧②”过程中,Fe元素被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com