
【题目】常温下,向10mL bmol·L-1的CH3COOH溶液中逐渐滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(CH3COO-)=c(Na+),下列说法正确的是( )
A. b<0.01
B. 混合后溶液酸碱性无法判断
C. CH3COOH的电离常数Ka=![]()
D. 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
【答案】C
【解析】常温下,向10mL bmol·L-1的CH3COOH溶液中逐渐滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(CH3COO-)=c(Na+),依据溶液中电荷守恒分析可知溶液呈中性,醋酸略微过量,则A、恰好反应生成醋酸钠溶液呈碱性,若溶液呈中性,醋酸过量,b>0.01,A错误;B、根据以上分析可知溶液呈中性,B错误;C、溶液呈中性,c(OH-)=c(H+)=10-7mol/L,c(CH3COO-)=c(Na+)=0.005mol/L,电离平衡常数K=c(CH3COO)c(H+)/c(CH3COOH)=![]() ,C正确;D、随反应进行,水的抑制程度减弱,水电离程度增大,D错误;答案选C。
,C正确;D、随反应进行,水的抑制程度减弱,水电离程度增大,D错误;答案选C。


科目:高中化学 来源: 题型:
【题目】格氏试剂在有机合成方面用途广泛,可用卤代烃和镁在醚类溶剂中反应制得。设R为烃基,已知:
①RX +Mg![]() R-MgX(格氏试剂);
R-MgX(格氏试剂);
②
阅读以下合成路线图,回答有关问题:
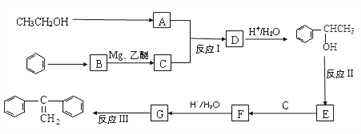
(1)反应I的类型是_____________,反应II的条件是___________________ 。
(2)反应III的化学方程式为____________________________________ 。
(3)E的同分异构体中,含有苯环且能发生银镜反应的有机物共有____种。
(4)有机物 ![]() 是合成药物中的一种原料,实验室可用下列合成路线合成该有机物:
是合成药物中的一种原料,实验室可用下列合成路线合成该有机物:
其中Z的结构简式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)![]() 2HI(g)△H<0.改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
2HI(g)△H<0.改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
①升高温度________;
②加入催化剂________;
③充入更多的H2________;
④保持容器中压强不变,充入氖气________;
⑤保持容器容积不变,通入氖气________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牙齿表面由一层硬的成分为Ca5(PO4)3OH的物质保护,它在唾液中存在下列平衡:Ca5(PO4)3OH![]() 5Ca2+ +3PO43-+OH-,已知Ca5(PO4)3F(s)的溶解度比Ca5(PO4)3OH(s)更小,为了保护牙齿,世界各地均采用了不同的措施。以下措施中不能保护牙齿的是( )
5Ca2+ +3PO43-+OH-,已知Ca5(PO4)3F(s)的溶解度比Ca5(PO4)3OH(s)更小,为了保护牙齿,世界各地均采用了不同的措施。以下措施中不能保护牙齿的是( )
A. 少吃甜食 B. 多喝碳酸饮料
C. 在牙膏中加入氟化物添加剂 D. 在牙膏中添加适量的Ca2+或PO43-离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X和Y两元素组成化合物A和B,A的化学式为XY2,其中X占44.1%,B中X占34.5%,则B的化学式为( )
A.X2YB.XYC.XY3D.X3Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中①NaCl晶体 ②液态S03 ③醋酸 ④汞 ⑤BaS04固体 ⑥酒精 ⑦熔化的KN03 属于电解质的是(填序号)_________________________
(2)质量为3.9 g的Na2X中含有Na+的物质的量为0.1mol,则Na2X的摩尔质量为______,
(3)某气体对氧气的相对密度为2,则此气体的相对分子质量为______
(4)3.01×1022个S2-的物质的量为________,质量为________,含有质子的物质的量为______,含有电子的物质的量为________。
(5)某地酸雨经检验,除含氢离子外,还有如下离子:c(Na+)=1.4×10-3 mol·L-1 ,c(Cl-) =3.5×10-3 mol·L-1 ,c(NH) =2.3×10-3 mol·L-1 , c(SO![]() ) =1.5×10-3 mol·L-1。则该溶液中氢离子的浓度为_____________ mol·L-1。
) =1.5×10-3 mol·L-1。则该溶液中氢离子的浓度为_____________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高压电机,复印机工作时会产生臭氧,该气体有强氧化性。下列叙述不正确的是( )
A、臭氧和氧气互为同素异形体 B、臭氧可使KI淀粉试纸变蓝
C、臭氧的存在对人体有益无害 D、臭氧是很好的消毒剂和脱色剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的催化氧化: ![]() ,是工业制取硫酸的关键步骤之一。在容积都为2L的
,是工业制取硫酸的关键步骤之一。在容积都为2L的![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五个密闭容器中,投入相同的催化剂,并均充入1mol O2和2mol SO2,控制不同的反应温度进行反应,反应进行到5min时,测得相关数据如下表:
五个密闭容器中,投入相同的催化剂,并均充入1mol O2和2mol SO2,控制不同的反应温度进行反应,反应进行到5min时,测得相关数据如下表:
容器温度 物质的量(mol) |
400℃ |
425℃ |
450℃ |
475℃ |
500℃ |
O2 | 0.8 | 0.6 | 0.3 | 0.5 | 0.7 |
SO3 | 0.4 | 0.8 | 1.4 | 1.0 | 0.6 |
(1)计算5min内![]() 容器中SO2的平均反应速率___________________________。
容器中SO2的平均反应速率___________________________。
(2)反应进行到5min时, ![]() 容器中的反应是否达到平衡状态?_______(填“已达”、“未达”)理由是:_________________________________________________
容器中的反应是否达到平衡状态?_______(填“已达”、“未达”)理由是:_________________________________________________
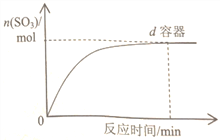
(3)在右图中画出![]() 容器中SO3物质的量随时间的变化曲线。____________
容器中SO3物质的量随时间的变化曲线。____________
(4)工业上常用Na2SO3溶液来吸收SO2,该反应的离子方程式是:______________________。
(5)Na2SO3和NaHSO3混合溶液的pH随Na2SO3和NaHSO3比例的不同而不同,数据如下:
序号 | ① | ② | ③ |
| 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
表中第________组(填写序号)数据,可判断NaHSO3溶液显_______性(填“酸”或“碱”)。
(6)NaHSO3既能和强酸反应也能和强碱溶液反应。用平衡移动原理说明NaHSO3能和强碱溶液反应的原因:_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中含有的可溶性杂质CaCl2、MgCl2和Na2SO4,需进行下列实验操作,请在()中填写所使用除杂试剂的化学式_____、____、_____、_____、_____,在![]() 中填写实验操作名称_____、_____、_____。
中填写实验操作名称_____、_____、_____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com