
【题目】SO2的催化氧化: ![]() ,是工业制取硫酸的关键步骤之一。在容积都为2L的
,是工业制取硫酸的关键步骤之一。在容积都为2L的![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五个密闭容器中,投入相同的催化剂,并均充入1mol O2和2mol SO2,控制不同的反应温度进行反应,反应进行到5min时,测得相关数据如下表:
五个密闭容器中,投入相同的催化剂,并均充入1mol O2和2mol SO2,控制不同的反应温度进行反应,反应进行到5min时,测得相关数据如下表:
容器温度 物质的量(mol) |
400℃ |
425℃ |
450℃ |
475℃ |
500℃ |
O2 | 0.8 | 0.6 | 0.3 | 0.5 | 0.7 |
SO3 | 0.4 | 0.8 | 1.4 | 1.0 | 0.6 |
(1)计算5min内![]() 容器中SO2的平均反应速率___________________________。
容器中SO2的平均反应速率___________________________。
(2)反应进行到5min时, ![]() 容器中的反应是否达到平衡状态?_______(填“已达”、“未达”)理由是:_________________________________________________
容器中的反应是否达到平衡状态?_______(填“已达”、“未达”)理由是:_________________________________________________
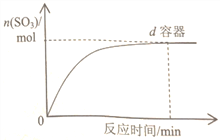
(3)在右图中画出![]() 容器中SO3物质的量随时间的变化曲线。____________
容器中SO3物质的量随时间的变化曲线。____________
(4)工业上常用Na2SO3溶液来吸收SO2,该反应的离子方程式是:______________________。
(5)Na2SO3和NaHSO3混合溶液的pH随Na2SO3和NaHSO3比例的不同而不同,数据如下:
序号 | ① | ② | ③ |
| 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
表中第________组(填写序号)数据,可判断NaHSO3溶液显_______性(填“酸”或“碱”)。
(6)NaHSO3既能和强酸反应也能和强碱溶液反应。用平衡移动原理说明NaHSO3能和强碱溶液反应的原因:_________________________________________________________。
【答案】 0.04mol/(Lmin) 未达 SO2的催化氧化是放热反应,温度越高,K值越小,5min时c容器中SO2转化率高于b容器,因此b容器中的SO2还能继续转化 图略 SO32-+SO2+H2O=2HSO3- ③ 酸 NaHSO3溶液中HSO3-发生电离:HSO3-![]() H++SO3-,电离出的H+与强碱溶液中的OH-发生反应,其浓度降低,平衡正向移动,使反应能持续进行
H++SO3-,电离出的H+与强碱溶液中的OH-发生反应,其浓度降低,平衡正向移动,使反应能持续进行
【解析】(1)a容器中氧气起始浓度=1mol,5min末浓度为08mol,V==0.020 mol/(Lmin),而二氧化硫的速率是氧气的二倍故氧气的速率为0.040mol/Lmin;(2)从表中的数据可以看出氧气的物质的量呈先减小再增大的趋势,说明该反应是放热反应,温度越高,K值越小,5min时c容器中SO2转化率高于b容器,因此b容器中的SO2还能继续转化 ,未达到平衡状态。
(3)e容器比d容器中温度高,所以反应速率大,到达平衡所用的时间短,但是不利于生成二氧化硫,平衡时生成的二氧化硫少,对应的图像为: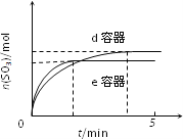
(4)Na2SO3还可以和SO2反应生成NaHSO3对应的方程式为:SO32-+SO2+H2O=2HSO3-
(5)③溶液中存在SO32-和HSO3-两种离子,SO32-要水解使溶液显碱性,HSO3-既能水解又能电离,水解使溶液显碱性,电离使溶液显酸性,而此混合溶液显酸性,就说明NaHSO3的电离程度大于水解程度,溶液显酸性。(6)NaHSO3溶液中HSO3-发生电离:HSO3-![]() H++SO3-,电离出的H+与强碱溶液中的OH-发生反应,其浓度降低,平衡正向移动,使反应能持续进行。
H++SO3-,电离出的H+与强碱溶液中的OH-发生反应,其浓度降低,平衡正向移动,使反应能持续进行。


科目:高中化学 来源: 题型:
【题目】按要求填空
(1)画出羟基和乙烯的电子式:羟基 __________,乙烯 __________。
(2)用系统命名法给下列有机物命名
![]() ___________________________;
___________________________;
②![]() ___________________________________;
___________________________________;
(3)相对分子质量为114,其一氯代物只有一种的链烃的结构简式 ___________该物质的名称为________________;
(4)某烃1分子含有50个电子,该烃只能由一种结构的炔烃加氢得到,则该烃的键线式为 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL bmol·L-1的CH3COOH溶液中逐渐滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(CH3COO-)=c(Na+),下列说法正确的是( )
A. b<0.01
B. 混合后溶液酸碱性无法判断
C. CH3COOH的电离常数Ka=![]()
D. 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,有两种盐的稀溶液,分别是![]() mol/L NaX溶液和
mol/L NaX溶液和![]() mol/L NaY溶液,下列判断错误的是( )
mol/L NaY溶液,下列判断错误的是( )
A. 若![]() ,测得
,测得![]() ,则溶液中的
,则溶液中的![]()
B. 若![]() ,测得
,测得![]() ,则溶液中的
,则溶液中的![]()
C. 若![]() ,且
,且![]() ,则酸性:
,则酸性: ![]()
D. 若![]() ,并测得
,并测得![]() ,则HX是强酸,HY是弱酸
,则HX是强酸,HY是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】惕格酸(C5H8O2,分子中有两个甲基)可用于制备香精,由烃A生成惕格酸的反应如下:
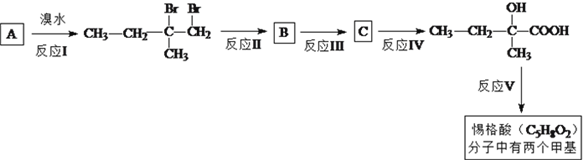
完成下列填空:
(1)写出反应类型。反应I:_____________反应、反应V:_______________反应。
(2)写出反应II试剂和反应条件:________________________________________。
(3)写出反应III的化学反应方程式:___________________________________________。
(4)如何检验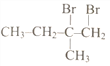 中的溴元素?____________________________________。
中的溴元素?____________________________________。
(5)写出符合下列条件的惕格酸的同分异构体的结构简式:_________________________。条件:与惕格酸含相同官能团,且也有两个甲基。 溴代甲基环己烷(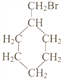 也可表示为
也可表示为![]() )可通过反应合成1-甲基环己烯(
)可通过反应合成1-甲基环己烯(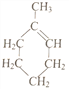 也可表示为
也可表示为![]() )
)
(6)设计一条以溴代甲基环己烷为原料合成1-甲基环己烯的合成路线。(合成路线常用的表示方式为: ![]() )________________
)________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素CO(NH2)2,原理如图。下列有关说法正确的是( )
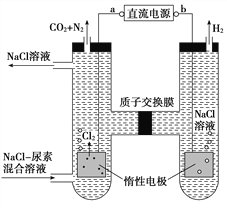
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 阳极室中发生的电极反应为2H++2e-=H2↑
D. 若两极共收集到气体产品13.44 L(标准状况),则除去的尿素为7.2 g(忽略气体的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下反应中,①铁丝在氧气中燃烧 ②加热碳和氧化铜的混合物③碳酸钠和硫酸反应 ④加热高锰酸钾固体 ⑤锌和稀硫酸反应 ⑥硫酸钠溶液和氯化钡溶液混合。属于离子反应的有___________(填各反应的序号,下同),属于氧化还原反应的___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N、S、Cl元素可形成多种物质,在工业生产上有着广泛的应用。回答下列问题:
(1)Fe3+可与SCN-形成多种配离子,其中一种为[Fe(SCN)6]3-,该配离子中的SCN-会使铁的剩余价电子压缩配对,则每个配离子中铁的单电子个数为_______个。
(2)Se与S是同族元素,请写出基态Se原子电子排布式______。N与S是不同族元素,请解释NH3比H2S在水中溶解度大的原因:__________________。
(3)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__________。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__________。
(4)已知S4O62-的结构为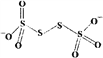 ,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
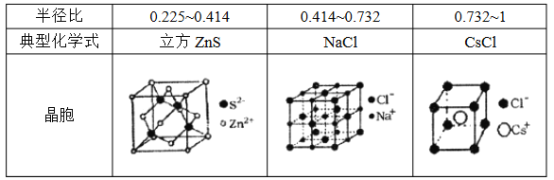
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为_________,晶体的密度为_________g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com