
【题目】已知N、S、Cl元素可形成多种物质,在工业生产上有着广泛的应用。回答下列问题:
(1)Fe3+可与SCN-形成多种配离子,其中一种为[Fe(SCN)6]3-,该配离子中的SCN-会使铁的剩余价电子压缩配对,则每个配离子中铁的单电子个数为_______个。
(2)Se与S是同族元素,请写出基态Se原子电子排布式______。N与S是不同族元素,请解释NH3比H2S在水中溶解度大的原因:__________________。
(3)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__________。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__________。
(4)已知S4O62-的结构为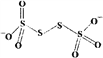 ,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
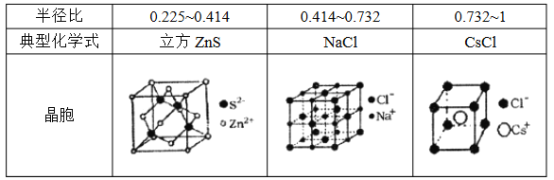
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为_________,晶体的密度为_________g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
【答案】 1 [Ar]3d104s24p4 NH3可与H2O之间形成氢键,而H2S不能,所以NH3比H2S在水中的溶解度大 OF2 1∶1 sp3杂化 由于电负性N>P>H,且N原子半径小于P原子半径,NH3中成键电子对彼此相距更近,斥力更大,所以键角NH3>PH3 (或者:电负性N>P>H,NH3中N原子上的孤电子对比PH3中P原子上的孤电子对离核更近,对成键电子对排斥力更小,所以键角NH3>PH3) 4 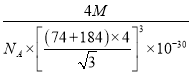
【解析】(1) [Fe(SCN)6]3-中的铁为+3价,剩余价电子为![]() ,单电子为5个,由于SCN-会使铁的剩余价电子压缩配对:
,单电子为5个,由于SCN-会使铁的剩余价电子压缩配对:![]() ,所以每个配离子中铁的单电子个数为1个。(2)34号元素Se的基态电子排布为1s22s22p63s23p63d104s24p4或[Ar]3d104s24p4;N的电负性3.0远大于H的2.1,使得NH3中N—H键极性非常强,N原子带有明显的负电荷,H2O强极性O—H中的H几乎成为裸露的质子,NH3分子与H2O分子间形成了O—H…N氢键,使NH3在水有很大的溶解度。而S的电负性只有2.5,H2S中S所带负电荷不足以使H2S与H2O形成氢键,所以H2S在水中溶解度较小。(3)据等电子体原理的判断方法,前1~9号元素形成的物质中,只有OF2与SCl2互为等电子体。CO2的分子结构为O=C=O,其中σ键和π键的个数比为2∶2=1∶1,SCN-与CO2互为等电子体,所以SCN-中σ键和π键的个数比为也1∶1。(4)S4O62-的结构中两边的S原子均形成4个σ键且无孤对电子,所以均为sp3杂化;中间的两个S原子均形成两个单键,且均有两对孤对电子,所以均为sp3杂化。NH3和PH3均是三角锥形结构,都有一对孤对电子的斥力影响,由于电负性N>P>H,且N原子半径小于P原子半径,NH3中成键电子对彼此相离更近,斥力更大,所以键角NH3>PH3。(5)据74÷184≈0.402,所以该晶体的晶胞为立方ZnS型,晶胞中可以明显看出阴离子的配位数为4,由于阴阳离子个数比为1∶1,所以阳离子的配位数为4。密度计算以1mol晶胞含4mol作为计算对象,由于一个晶胞含有4个RA,阴阳离子半径之和为体对角线的1/4,且体对角线为晶胞边长的
,所以每个配离子中铁的单电子个数为1个。(2)34号元素Se的基态电子排布为1s22s22p63s23p63d104s24p4或[Ar]3d104s24p4;N的电负性3.0远大于H的2.1,使得NH3中N—H键极性非常强,N原子带有明显的负电荷,H2O强极性O—H中的H几乎成为裸露的质子,NH3分子与H2O分子间形成了O—H…N氢键,使NH3在水有很大的溶解度。而S的电负性只有2.5,H2S中S所带负电荷不足以使H2S与H2O形成氢键,所以H2S在水中溶解度较小。(3)据等电子体原理的判断方法,前1~9号元素形成的物质中,只有OF2与SCl2互为等电子体。CO2的分子结构为O=C=O,其中σ键和π键的个数比为2∶2=1∶1,SCN-与CO2互为等电子体,所以SCN-中σ键和π键的个数比为也1∶1。(4)S4O62-的结构中两边的S原子均形成4个σ键且无孤对电子,所以均为sp3杂化;中间的两个S原子均形成两个单键,且均有两对孤对电子,所以均为sp3杂化。NH3和PH3均是三角锥形结构,都有一对孤对电子的斥力影响,由于电负性N>P>H,且N原子半径小于P原子半径,NH3中成键电子对彼此相离更近,斥力更大,所以键角NH3>PH3。(5)据74÷184≈0.402,所以该晶体的晶胞为立方ZnS型,晶胞中可以明显看出阴离子的配位数为4,由于阴阳离子个数比为1∶1,所以阳离子的配位数为4。密度计算以1mol晶胞含4mol作为计算对象,由于一个晶胞含有4个RA,阴阳离子半径之和为体对角线的1/4,且体对角线为晶胞边长的![]() 倍,所以密度的计算式
倍,所以密度的计算式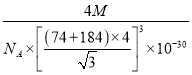 g/cm3。
g/cm3。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】SO2的催化氧化: ![]() ,是工业制取硫酸的关键步骤之一。在容积都为2L的
,是工业制取硫酸的关键步骤之一。在容积都为2L的![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五个密闭容器中,投入相同的催化剂,并均充入1mol O2和2mol SO2,控制不同的反应温度进行反应,反应进行到5min时,测得相关数据如下表:
五个密闭容器中,投入相同的催化剂,并均充入1mol O2和2mol SO2,控制不同的反应温度进行反应,反应进行到5min时,测得相关数据如下表:
容器温度 物质的量(mol) |
400℃ |
425℃ |
450℃ |
475℃ |
500℃ |
O2 | 0.8 | 0.6 | 0.3 | 0.5 | 0.7 |
SO3 | 0.4 | 0.8 | 1.4 | 1.0 | 0.6 |
(1)计算5min内![]() 容器中SO2的平均反应速率___________________________。
容器中SO2的平均反应速率___________________________。
(2)反应进行到5min时, ![]() 容器中的反应是否达到平衡状态?_______(填“已达”、“未达”)理由是:_________________________________________________
容器中的反应是否达到平衡状态?_______(填“已达”、“未达”)理由是:_________________________________________________
(3)在右图中画出![]() 容器中SO3物质的量随时间的变化曲线。____________
容器中SO3物质的量随时间的变化曲线。____________
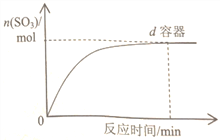
(4)工业上常用Na2SO3溶液来吸收SO2,该反应的离子方程式是:______________________。
(5)Na2SO3和NaHSO3混合溶液的pH随Na2SO3和NaHSO3比例的不同而不同,数据如下:
序号 | ① | ② | ③ |
| 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
表中第________组(填写序号)数据,可判断NaHSO3溶液显_______性(填“酸”或“碱”)。
(6)NaHSO3既能和强酸反应也能和强碱溶液反应。用平衡移动原理说明NaHSO3能和强碱溶液反应的原因:_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中含有的可溶性杂质CaCl2、MgCl2和Na2SO4,需进行下列实验操作,请在()中填写所使用除杂试剂的化学式_____、____、_____、_____、_____,在![]() 中填写实验操作名称_____、_____、_____。
中填写实验操作名称_____、_____、_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质的电离方程式如下:
HClO4=H++ClO4-;
Ba(OH)2=Ba2++2OH-;
Fe2(SO4)3=2Fe3++3SO42-;
KHSO4=K++H++SO42-
属于酸的物质是__________(写化学式);属于碱的物质是__________;属于盐的物质是______________。
(2)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
①从物质的分类角度看,不恰当的一种物质是________________________________。
②上述物质中既不是电解质也不是非电解质的是_________________
③写出纯碱的电离方程式:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,世界上多采用电解熔融氯化钠的方法来生产金属钠:2NaCl(熔融) ![]() 2Na+Cl2↑。已知A、B、C、D、E有如下转化关系:
2Na+Cl2↑。已知A、B、C、D、E有如下转化关系:
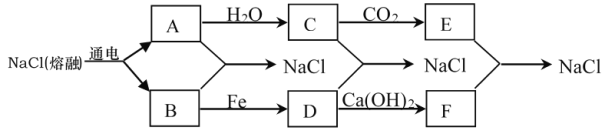
(1)写出A、B生成NaCl的化学方程式:_____________________________________。
(2)写出化学式:C______________,D_____________。
(3)工业生产中常利用B与Ca(OH)2反应来制备漂白粉,漂白粉的主要成分是_______________________________。(写化学式)
(4)若把A投入盛有D的溶液中,溶液中出现________________(填沉淀颜色)沉淀,该过程所发生反应的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苄丙酮香豆素(H)常用于防治血觑栓栓塞性疾病。其合成路线如图所示(部分反应条件略去。)
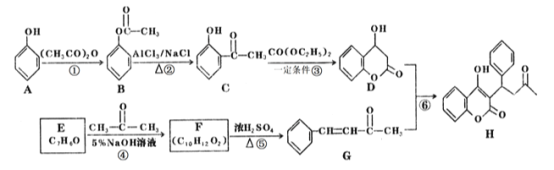
(1)E的名称是_________,D中含氧官能团的名称是_________。
(2)反应①的反应类型是__________,反应⑤的反应类型是_________。
(3)1mol H与H2加成,最多可消耗_____mol H2。
(4)反应③的化学方程式为____________________________________。
(5)C的同分异构体中满足下列条件的有______种,其中核磁共振氢谱有4组峰且峰面积之比为1:2:2:3的结构简式为__________(写一种即可)。
①不能和FeCl3溶液发生显色反应 ②1mol该有机物能与2molNaOH恰好完全反应
(6)参照苄丙酮香豆素的合成路线,设计一种以E和乙醛为原料制备![]() 的合成路线________。
的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于ag H2和bg He 的说法正确的是
A. 同温同压下,H2和He的体积比是a:b
B. 同温同压下,若a=b,则H2与He的物质的量之比是2:1
C. 体积相同时,He 的质量一定大于H2的质量
D. 同温同压下,若二者的物质的量相等,其密度也相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.把煤粉碎了再燃烧可以提高煤的燃烧效率
B.增加炼铁高炉的高度可以降低尾气中CO的含量
C.无论加入正催化剂还是加入负催化剂都能大大提高化学反应速率
D.用完的电池可以随意地丢弃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com