
【题目】下列说法中正确的是
A.把煤粉碎了再燃烧可以提高煤的燃烧效率
B.增加炼铁高炉的高度可以降低尾气中CO的含量
C.无论加入正催化剂还是加入负催化剂都能大大提高化学反应速率
D.用完的电池可以随意地丢弃
科目:高中化学 来源: 题型:
【题目】已知N、S、Cl元素可形成多种物质,在工业生产上有着广泛的应用。回答下列问题:
(1)Fe3+可与SCN-形成多种配离子,其中一种为[Fe(SCN)6]3-,该配离子中的SCN-会使铁的剩余价电子压缩配对,则每个配离子中铁的单电子个数为_______个。
(2)Se与S是同族元素,请写出基态Se原子电子排布式______。N与S是不同族元素,请解释NH3比H2S在水中溶解度大的原因:__________________。
(3)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__________。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__________。
(4)已知S4O62-的结构为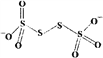 ,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
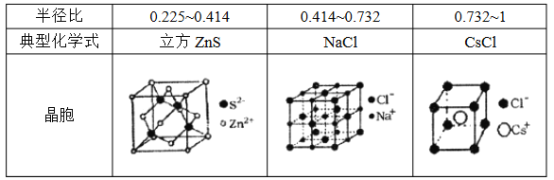
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为_________,晶体的密度为_________g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
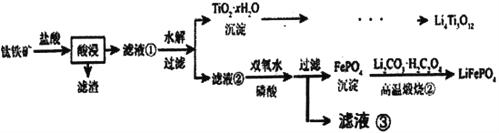
已知:“酸浸”后,钛主要以TiOCl42-形式存在
FeTiO3+4H++4C1-=Fe2++ TiOCl42-+2H2O
下列说法不正确的是
A. Li2Ti5O15中Ti的化合价为+4,其中有4个过氧键
B. 滤液②中的阳离子除了Fe2+和H+,还有Mg2+
C. 滤液②中也可以直接加适量的氯水代替双氧水
D. “高温煅烧②”过程中,Fe元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在离子化合物中,可能含共价键
B.在共价化合物中,可能含离子键
C.含共价键的化合物一定是共价化合物
D.含离子键的化合物不一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. H2SO4的摩尔质量是98
B. 等质量的O2和O3中所含的氧原子数相同
C. 等质量的CO与CO2中所含碳原子数之比为7︰11
D. 98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是( )
A. c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) B. c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
C. c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-) D. 两溶液中的c(Na+)、c(HRO3-)和c(RO32-)分别相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解后,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.回答下列问题:
(1)为除去溶液中的Fe2+,可先加入______(填化学式)将Fe2+氧化为Fe3+,反应的离子方程式为__________,然后再加入适量的__________调整溶液的pH到______,使Fe3+转化为Fe(OH)3。
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 molL-1时就认为沉淀完全,设溶液中CuSO4的浓度为3molL-1,则Cu(OH)2开始沉淀时溶液的pH为______,Fe3+完全沉淀时溶液的pH为______,通过计算确定上述方案______ (填“可行”或“不可行”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com