
【题目】已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是( )
A. c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) B. c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
C. c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-) D. 两溶液中的c(Na+)、c(HRO3-)和c(RO32-)分别相等
【答案】B
【解析】A,NaHSO3溶液呈酸性说明HSO3-的电离程度大于HSO3-的水解程度,NaHSO3溶液中离子浓度由大到小的顺序为c(Na+)![]() c(HSO3-)
c(HSO3-)![]() c(H+)
c(H+)![]() c(SO32-)
c(SO32-)![]() c(OH-),NaHCO3溶液呈碱性说明HCO3-的水解程度大于HCO3-的电离程度,NaHCO3溶液中离子浓度由大到小的顺序为c(Na+)
c(OH-),NaHCO3溶液呈碱性说明HCO3-的水解程度大于HCO3-的电离程度,NaHCO3溶液中离子浓度由大到小的顺序为c(Na+)![]() c(HCO3-)
c(HCO3-)![]() c(OH-)
c(OH-)![]() c(H+)
c(H+)![]() c(CO32-),A项错误;B,两溶液中电荷守恒为c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),物料守恒为c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3),两式整理得c(H+)+c(H2RO3)=c(RO32-)+c(OH-),B项正确;C,两溶液中电荷守恒为c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),C项错误;D,两溶液中c(Na+)相等,但c(HRO3-)、c(RO32-)不相等,D项错误;答案选B。
c(CO32-),A项错误;B,两溶液中电荷守恒为c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),物料守恒为c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3),两式整理得c(H+)+c(H2RO3)=c(RO32-)+c(OH-),B项正确;C,两溶液中电荷守恒为c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),C项错误;D,两溶液中c(Na+)相等,但c(HRO3-)、c(RO32-)不相等,D项错误;答案选B。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.把煤粉碎了再燃烧可以提高煤的燃烧效率
B.增加炼铁高炉的高度可以降低尾气中CO的含量
C.无论加入正催化剂还是加入负催化剂都能大大提高化学反应速率
D.用完的电池可以随意地丢弃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
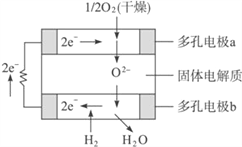
①多孔电极a为负极
②a极对应的电极反应式为O2+2H2O+4e-==4OH-
③b极的电极反应式为H2-2e-+O2-==H2O
④该电池的总反应式为2H2+O2![]() 2H2O
2H2O
A. ①② B. ②④ C. ②③ D. ③ ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂(Pt)可以和很多化合物形成配合物,生产生活中有重要的用途。
(1)铂和氨水可以形成配合物。可用于提取铂。氨水中各元素的第一电离能由大到小的顺序___。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体,科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①C1-的核外电子排布式为_______。
②吡啶分子是大体积平面配体,其结构简式为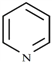 ,吡啶分子中氮原子的轨道杂化方式是_____,分子中的大π键可用符号
,吡啶分子中氮原子的轨道杂化方式是_____,分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π鍵的电子数,则吡啶中的大π键应表示为_____;1mol吡啶中含有σ键的数目为________
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π鍵的电子数,则吡啶中的大π键应表示为_____;1mol吡啶中含有σ键的数目为________
③二氯二吡啶合铂分子中存在的微粒间作用力有_____(填字母)。
a.离子健 b.配位键c.金属键 d.非极性键e.氢键f.极性键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。简述理由_____________。
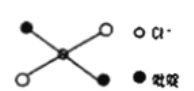
⑤反式二氯二吡啶合铂分子结构如图所示,该分子是_____分子(其“极性”或“非极性”)。
(3)富勒烯C60能够与Pt结合形成一系列络合物。富勒烯(C60)的结构如图所示,C60属于____晶体;C60分子中五元环与六元环的数目比为__________。
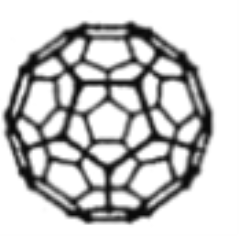
(已知简单多面体的顶点数V、棱数E及面数F间有如下关系:V-E+F=2)。
(4)金属铂立方晶胞的二维投影图如图所示。若金属铂的密度dg/cm3,则晶胞参数a=___nm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
I.工业生产精细化工产品乙二醛(OHC-CHO)
(1)乙醇(CH3CH2OH)液相硝酸氧化法:在Cu(NO3)2催化下,用稀硝酸氧化乙醇制取乙二醛,此反应的化学方程式为_______________。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点____________。
(2)乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g) ![]() 2H2O(g)ΔH=-484kJ/mol,化学平衡常数为K1
2H2O(g)ΔH=-484kJ/mol,化学平衡常数为K1
OHC-CHO(g)+2H2(g) ![]() HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) ![]() OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
Ⅱ.CO2的综合利用
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
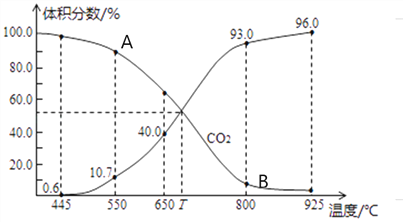
a.反应达平衡状态时,混合气体的平均相对分子质量保持不变
b.A点的正反应速率比B点正反应速率小
C.550℃时,若充入氦气,则V正、V逆均减小,平衡不移动
d.T℃时,反应达平衡后CO2的转化率为66.7%
e. T℃时,若再充入1molCO2和1molCO,平衡不移动
(4)氨气、CO2在一定条件下可合成尿素,其反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
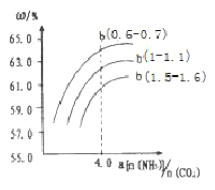
①b应控制在______
a.1.5-1.6b.1-1.1c.0.6-0.7
②a应控制在4.0的理由是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)储氢纳米碳管的研究成功体现了科技的进步,但用电孤法合成的碳纳米管常伴有大量的杂质-碳纳米颗粒,可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7 + 8H2SO4= 3CO2 + 2K2SO4+ 2Cr2(SO4)3 + 8H2O
①请用双线桥法标出电子转移方向和数目__________________________________
②上述反应中氧化剂是___________________(填化学式)。
(2)按如图所示操作,充分反应后:

①Ⅰ中发生反应的离子方程式为_________________________________________
②结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com