
【题目】铂(Pt)可以和很多化合物形成配合物,生产生活中有重要的用途。
(1)铂和氨水可以形成配合物。可用于提取铂。氨水中各元素的第一电离能由大到小的顺序___。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体,科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①C1-的核外电子排布式为_______。
②吡啶分子是大体积平面配体,其结构简式为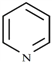 ,吡啶分子中氮原子的轨道杂化方式是_____,分子中的大π键可用符号
,吡啶分子中氮原子的轨道杂化方式是_____,分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π鍵的电子数,则吡啶中的大π键应表示为_____;1mol吡啶中含有σ键的数目为________
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π鍵的电子数,则吡啶中的大π键应表示为_____;1mol吡啶中含有σ键的数目为________
③二氯二吡啶合铂分子中存在的微粒间作用力有_____(填字母)。
a.离子健 b.配位键c.金属键 d.非极性键e.氢键f.极性键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。简述理由_____________。
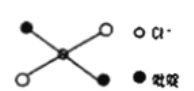
⑤反式二氯二吡啶合铂分子结构如图所示,该分子是_____分子(其“极性”或“非极性”)。
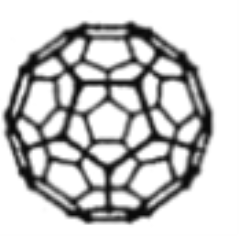
(3)富勒烯C60能够与Pt结合形成一系列络合物。富勒烯(C60)的结构如图所示,C60属于____晶体;C60分子中五元环与六元环的数目比为__________。
(已知简单多面体的顶点数V、棱数E及面数F间有如下关系:V-E+F=2)。
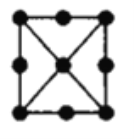
(4)金属铂立方晶胞的二维投影图如图所示。若金属铂的密度dg/cm3,则晶胞参数a=___nm(列出计算式即可)。
【答案】 N>O>H 1s22s22p63s23p6或[Ne]3s23p6 sp2杂化 ![]() 11NA bdf 若Pt2+以sp3杂化轨道进行配位,则二氯二吡啶合铂为四面体结构,不存在顺反异构体(二氯二吡啶合铂分子存在顺反两种构型,若为sp3杂化则不存在顺反异构) 非极性 分子 3:5
11NA bdf 若Pt2+以sp3杂化轨道进行配位,则二氯二吡啶合铂为四面体结构,不存在顺反异构体(二氯二吡啶合铂分子存在顺反两种构型,若为sp3杂化则不存在顺反异构) 非极性 分子 3:5 ![]() 107或
107或![]()
【解析】试题分析:本题考查第一电离能的比较、核外电子排布式的书写、杂化方式的判断、σ键的计算、微粒间作用力的分析、分子极性的判断、晶体类型的判断、晶胞结构的分析和计算。
(1)氨水中的元素有H、N、O,H的非金属性最弱,H的第一电离能最小;O的价电子排布为2s22p4,N的价电子排布为2s22p3,N的2p处于半充满较稳定,第一电离能:N![]() O;氨水中各元素的第一电离能由大到小的顺序为N
O;氨水中各元素的第一电离能由大到小的顺序为N![]() O
O![]() H。
H。
(2)①Cl原子核外电子排布式为1s22s22p63s23p5,Cl-的核外电子排布式为1s22s22p63s23p6。
②由吡啶的结构简式可以看出,N原子形成2个σ键,N上还有1对孤电子对,吡啶分子中氮原子的杂化方式是sp2杂化。吡啶分子中5个碳原子也采取sp2杂化,每个C原子的未参与杂化的2p轨道上的1个电子和N原子的未参与杂化的2p轨道上的1个电子形成大π键,参与形成大π键的原子数为6、电子数为6,吡啶中的大π键表示为![]() 。1个吡啶分子中含4个碳碳σ键、2个碳氮σ键和5个碳氢σ键,1个吡啶分子中含11个σ键,1mol吡啶中含有σ键物质的量为11mol,含有的σ键的数目为11NA。
。1个吡啶分子中含4个碳碳σ键、2个碳氮σ键和5个碳氢σ键,1个吡啶分子中含11个σ键,1mol吡啶中含有σ键物质的量为11mol,含有的σ键的数目为11NA。
③二氯二吡啶合铂是由Pt2+、Cl- 和吡啶结合形成的铂配合物,Pt2+与Cl-、吡啶分子间为配位键,吡啶分子中存在碳碳非极性键、碳氢极性键、碳氮极性键,答案选bdf。
④根据题意,二氯二吡啶合铂有顺式和反式两种同分异构体;若Pt2+以sp3杂化轨道进行配位,则二氯二吡啶合铂为四面体结构,不存在顺反异构体,所以Pt2+的轨道杂化方式不是sp3。
⑤反式二氯二吡啶合铂的结构对称,正电中心和负电中心重合,反式二氯二吡啶合铂为非极性分子。
(3)C60由分子构成,C60属于分子晶体。设C60中五元环、六元环的个数依次为x、y,根据富勒烯的结构,每个碳原子被3个五元环或六元环共用,每个碳碳键被2个五元环或六元环共用,则顶点数V=60=(5x+6y)/3(①式),棱数E为(5x+6y)/2,面数F为x+y,根据关系式V-E+F=2列式:60-(5x+6y)/2+x+y=2(②式),联立①式和②式,解得x=12,y=20,五元环与六元环的数目比为12:20=3:5。
(4)根据金属铂立方晶胞的二维投影图可知,铂的晶胞为面心立方最密堆积(如图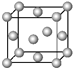 ),用“均摊法”,该晶胞中含Pt:8
),用“均摊法”,该晶胞中含Pt:8![]() +6
+6![]() =4,1mol晶体的体积为
=4,1mol晶体的体积为![]() =
=![]() cm3;1个晶胞的体积为
cm3;1个晶胞的体积为![]() cm3
cm3![]() NA
NA![]() 4=
4=![]() cm3,晶胞参数a=
cm3,晶胞参数a=![]() cm=
cm=![]() 107nm=
107nm=![]() nm。
nm。


科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
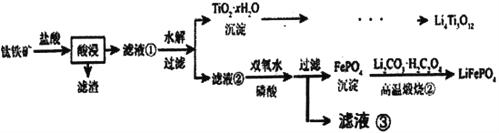
已知:“酸浸”后,钛主要以TiOCl42-形式存在
FeTiO3+4H++4C1-=Fe2++ TiOCl42-+2H2O
下列说法不正确的是
A. Li2Ti5O15中Ti的化合价为+4,其中有4个过氧键
B. 滤液②中的阳离子除了Fe2+和H+,还有Mg2+
C. 滤液②中也可以直接加适量的氯水代替双氧水
D. “高温煅烧②”过程中,Fe元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的是( )
A. c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) B. c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
C. c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-) D. 两溶液中的c(Na+)、c(HRO3-)和c(RO32-)分别相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 工业上电解熔融的Al2O3冶炼铝用铁做阳极
B. 用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1molNaOH
C. 用Pt做电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1∶2
D. 用碳棒做电极电解CuSO4溶液一段时间后,加入Cu(OH)2固体可以使CuSO4溶液恢复原来浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麻黄素是中枢神经兴奋剂,其合成路线如图所示。NBS是一种选择性溴代试剂。
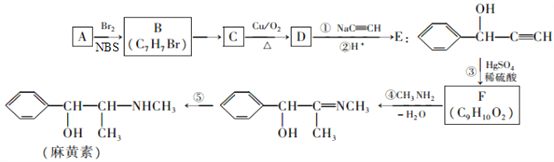
已知:①A的分子量为92
②
(1)其中A为烃,则A的分子式是__________
(2)写出B![]() C的化学方程式_______
C的化学方程式_______
(3)实验室检验D中官能团的方法为________。
(4)反应①的反应类型是______,F的结构简式是__________。
(5)有机物N与F互为同分异构体,满足下列条件的有机物N的结构有_____种;
①苯环上只有一个取代基 ②能发生水解反应 ③含有甲基
(6)参照上述合成路线信息,设计一条以乙醇为原料选用必要的试剂合成CH3CHOHCOCH3的流程。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.化学反应除了生成新的物质外,只伴随着热量的变化
B.物质燃烧不一定是放热反应,放热的化学反应不需要加热就能发生
C.太阳能、氢能、生物质能属于新能源
D.化石燃料是一次能源,乙醇是不可再生能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解后,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.回答下列问题:
(1)为除去溶液中的Fe2+,可先加入______(填化学式)将Fe2+氧化为Fe3+,反应的离子方程式为__________,然后再加入适量的__________调整溶液的pH到______,使Fe3+转化为Fe(OH)3。
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 molL-1时就认为沉淀完全,设溶液中CuSO4的浓度为3molL-1,则Cu(OH)2开始沉淀时溶液的pH为______,Fe3+完全沉淀时溶液的pH为______,通过计算确定上述方案______ (填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL 浓度均为0.100 mol·L-1的NaOH 溶液和二甲胺[(CH3)2NH]溶液,利用传感器测得滴定过程中溶液的电导率如图所示(已知常温下二甲胺的电离常数Kb=1.6×10-4)。下列说法正确的是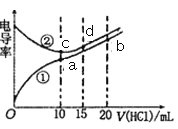
A. 曲线①代表滴定二甲胺溶液的曲线,pH=7时所消耗的V[HCl(aq)]大于10 mL
B. 在a、b、c 三点溶液中,水电离出的c(H+):a<c<b
C. 曲线中c点电导率最小,原因是c点溶液中导电微粒的数目最少
D. d 点溶液呈酸性,且有3c(H+)=c(Cl-)+3c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com