
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
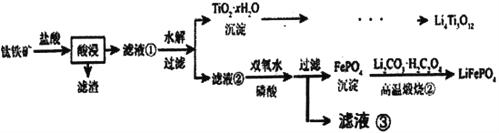
已知:“酸浸”后,钛主要以TiOCl42-形式存在
FeTiO3+4H++4C1-=Fe2++ TiOCl42-+2H2O
下列说法不正确的是
A. Li2Ti5O15中Ti的化合价为+4,其中有4个过氧键
B. 滤液②中的阳离子除了Fe2+和H+,还有Mg2+
C. 滤液②中也可以直接加适量的氯水代替双氧水
D. “高温煅烧②”过程中,Fe元素被氧化
【答案】D
【解析】用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备Li4Ti5O12和LiFePO4,由制备流程可知,加盐酸过滤后的滤渣为SiO2,滤液①中含Mg2+、Fe2+、TiOCl42-,水解后过滤,沉淀为TiO2·xH2O,经过一系列反应得到Li4Ti5O12;水解后的滤液②中含Mg2+、Fe2+,双氧水可氧化亚铁离子,在磷酸条件下过滤分离出FePO4,高温煅烧②中发生2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑。A. Li2Ti5O15中Ti的化合价为+4,Li为+1价,则O的化合价为-2价和-1价,根据正负化合价的代数和为0,其中含有7个-2价的O和8个-1价的O,结构中含有4个过氧键,故A正确;B. 根据上述分析,滤液②中的阳离子除了Fe2+和H+,还有Mg2+,故B正确;C. 滤液②中加入双氧水的目的是氧化亚铁离子,也可以直接加适量的氯水代替双氧水,故C正确;D. “高温煅烧②”过程中发生2FePO4+Li2CO3+H2C2O4
2LiFePO4+H2O+3CO2↑。A. Li2Ti5O15中Ti的化合价为+4,Li为+1价,则O的化合价为-2价和-1价,根据正负化合价的代数和为0,其中含有7个-2价的O和8个-1价的O,结构中含有4个过氧键,故A正确;B. 根据上述分析,滤液②中的阳离子除了Fe2+和H+,还有Mg2+,故B正确;C. 滤液②中加入双氧水的目的是氧化亚铁离子,也可以直接加适量的氯水代替双氧水,故C正确;D. “高温煅烧②”过程中发生2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑,Fe元素的化合价有+3价变成+2价,被还原,故D错误;故选D。
2LiFePO4+H2O+3CO2↑,Fe元素的化合价有+3价变成+2价,被还原,故D错误;故选D。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】为了除去粗盐中含有的可溶性杂质CaCl2、MgCl2和Na2SO4,需进行下列实验操作,请在()中填写所使用除杂试剂的化学式_____、____、_____、_____、_____,在![]() 中填写实验操作名称_____、_____、_____。
中填写实验操作名称_____、_____、_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于ag H2和bg He 的说法正确的是
A. 同温同压下,H2和He的体积比是a:b
B. 同温同压下,若a=b,则H2与He的物质的量之比是2:1
C. 体积相同时,He 的质量一定大于H2的质量
D. 同温同压下,若二者的物质的量相等,其密度也相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VmLAl2(SO4)3 溶液中含SO42- ag,取V/4mL溶液稀释到4VmL,则稀释后溶液Al3+中的物质的量浓度是
A. 125a/(576V) mol/L B. 125a/(288V)mol/L
C. 125a/(144V )mol/L D. 125a/(96V)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一种或几种组成,为了探究它的成份,进行了如下实验:下列判断正确的是
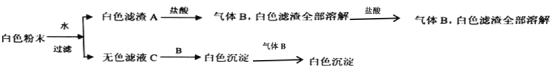
A. K2SO4、CuSO4一定不存在
B. BaCl2一定不存在
C. K2SO4、CaCO3、BaCl2一定存在
D. 滤液C中只含有BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、CO32-中的某一种。
Ⅰ.若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
Ⅱ.若向实验Ⅰ的四支试管中分别加盐酸,B盐溶液有沉淀产生E,D盐溶液有无色无味气体逸出。
根据实验Ⅰ、Ⅱ回答下列问题:
(1)C的名称为___________;D的化学式为______________。
(2)写出盐酸+B反应的离子方程式__________________,化学方程式与盐酸+D反应具有相同的离子方程式。
(3)将沉淀E过滤并洗涤,如何验证沉淀E已洗涤干净_____________________________。
(4)为检测C盐的一些性质,需配制240 mL 0.2 mol/L NaOH溶液,请回答下列问题:
①经计算,需用托盘天平称量固体NaOH的质量为__________g。
②在配制NaOH溶液时除烧杯、玻璃棒外,还需使用的玻璃仪器有________和_________。
③将NaOH浓溶液先____________,再转移到容量瓶中,否则溶液浓度__________(填“偏高”或“偏低”)。
④配制NaOH溶液时定容的操作:加蒸馏水距离刻度线__________处,改用_________滴加,至_______________与刻度线相切。
⑤取出配制好的溶液150mL,可以中和质量分数为36.5%,密度为1.20g/mL的盐酸的体积为____mL,配制该盐酸需HCl的体积为________mL(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.把煤粉碎了再燃烧可以提高煤的燃烧效率
B.增加炼铁高炉的高度可以降低尾气中CO的含量
C.无论加入正催化剂还是加入负催化剂都能大大提高化学反应速率
D.用完的电池可以随意地丢弃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂(Pt)可以和很多化合物形成配合物,生产生活中有重要的用途。
(1)铂和氨水可以形成配合物。可用于提取铂。氨水中各元素的第一电离能由大到小的顺序___。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体,科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①C1-的核外电子排布式为_______。
②吡啶分子是大体积平面配体,其结构简式为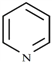 ,吡啶分子中氮原子的轨道杂化方式是_____,分子中的大π键可用符号
,吡啶分子中氮原子的轨道杂化方式是_____,分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π鍵的电子数,则吡啶中的大π键应表示为_____;1mol吡啶中含有σ键的数目为________
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π鍵的电子数,则吡啶中的大π键应表示为_____;1mol吡啶中含有σ键的数目为________
③二氯二吡啶合铂分子中存在的微粒间作用力有_____(填字母)。
a.离子健 b.配位键c.金属键 d.非极性键e.氢键f.极性键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。简述理由_____________。
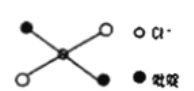
⑤反式二氯二吡啶合铂分子结构如图所示,该分子是_____分子(其“极性”或“非极性”)。
(3)富勒烯C60能够与Pt结合形成一系列络合物。富勒烯(C60)的结构如图所示,C60属于____晶体;C60分子中五元环与六元环的数目比为__________。
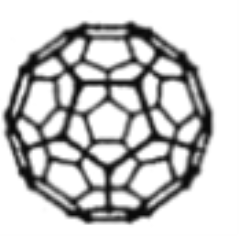
(已知简单多面体的顶点数V、棱数E及面数F间有如下关系:V-E+F=2)。
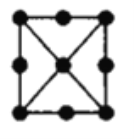
(4)金属铂立方晶胞的二维投影图如图所示。若金属铂的密度dg/cm3,则晶胞参数a=___nm(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com