
【题目】中科大陈乾旺教授等人发明![]() 合成金刚石的新方法,化学原理为:①
合成金刚石的新方法,化学原理为:①![]() (未配平)该方法比1955年人工首次制得金刚石的旧方法容易得多。②
(未配平)该方法比1955年人工首次制得金刚石的旧方法容易得多。②![]() 。以下表述正确的是( )
。以下表述正确的是( )
A. 反应①中既有旧化学键的断裂又有新化学键的形成
B. 新方法利用的是物理变化,旧方法利用的是化学变化
C. 在反应①中每生成![]() 金刚石需要消耗
金刚石需要消耗![]() 金属钠
金属钠
D. 反应①和反应②中所得的金刚石都是还原产物
科目:高中化学 来源: 题型:
【题目】三聚氰胺最早被李比希于1834年合成,它有毒,不可用于食品加工或食品添加剂。经李比希法分析得知,三聚氰胺分子中,氮元素的含量高达66.67%,氢元素的质量分数为4.76%,其余为碳元素。它的相对分子质量大于100,但小于150。试回答下列问题:
(1)分子式中原子个数比N(C)∶N (H)∶N(N)=________________________。
(2)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳氮两种元素组成的六元杂环。则三聚氰胺的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①大气固氮;②硝酸银分解;③实验室制取氨气等变化中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
A.①②③B.②①③C.③②①D.③①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】惕格酸(C5H8O2,分子中有两个甲基)可用于制备香精,由烃A生成惕格酸的反应如下:
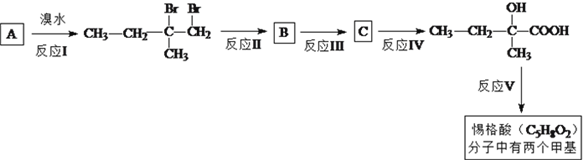
完成下列填空:
(1)写出反应类型。反应I:_____________反应、反应V:_______________反应。
(2)写出反应II试剂和反应条件:________________________________________。
(3)写出反应III的化学反应方程式:___________________________________________。
(4)如何检验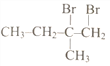 中的溴元素?____________________________________。
中的溴元素?____________________________________。
(5)写出符合下列条件的惕格酸的同分异构体的结构简式:_________________________。条件:与惕格酸含相同官能团,且也有两个甲基。 溴代甲基环己烷(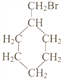 也可表示为
也可表示为![]() )可通过反应合成1-甲基环己烯(
)可通过反应合成1-甲基环己烯(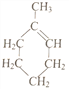 也可表示为
也可表示为![]() )
)
(6)设计一条以溴代甲基环己烷为原料合成1-甲基环己烯的合成路线。(合成路线常用的表示方式为: ![]() )________________
)________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是( )

A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6Kjmol﹣1
B.乙表示恒温恒容条件下发生的可逆反应2NO2![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度为2.00 mol/L的盐酸溶液1L,欲使其浓度变为4.00mol/L,下列方法可行的是( )
A. 蒸发掉0.5L水 B. 标况下通入44.8L HCl气体
C. 将溶液加热蒸发浓缩至0.5L D. 加入10mol/L盐酸0.6L,再将溶液稀释至2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用480mL、0.5mol/L 的稀硫酸,某同学用98%的浓硫酸(ρ=1.84g/cm3) 进行配制,请回答下列问题:
(1) 实验需要的玻璃仪器除了烧杯,胶头滴管、量简、玻璃棒,还需要__________;
(2)计算: 需用量筒量取浓硫酸的体积为__________ mL;
(3) 配制过程:
①用量筒量取所需的浓硫酸
②将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌,冷却至室温
③用玻璃棒引流将烧杯中的溶液转移到已经检漏的合适规格的容量瓶中
④洗涤烧杯和玻璃棒2~3 次,洗涤液也注入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀
⑤向容量流中加入蒸馏水,在距离刻度1~2cm 时,然后定容
⑥盖好瓶塞,反复上下颠倒,摇匀;
⑦将配制好的溶液转移至试剂瓶中待用。
上述步骤中一定用到胶头滴管的有__________(填序号);
若步骤⑤定容时加水超过刻度线,应该如何处置:___________。
(4) 在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”).
①所用的浓硫酸长时间放置在密封不好的容器中______;
②用量简量取浓硫酸时仰视液面______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:N2(g)+O2(g)![]() 2NO(g),△H=+180.50 kJ·mol-1;△S=247.7 J·mol-1·K-1。若该反应在一密闭容器中进行,若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
2NO(g),△H=+180.50 kJ·mol-1;△S=247.7 J·mol-1·K-1。若该反应在一密闭容器中进行,若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
A. 能使该反应物中活化分子数和活化分子百分数同时增大的方法只能是使用催化剂
B. 到达平衡状态时,v(N2)=2v(NO)
C. 在1000℃时,此反应能自发进行
D. 一定温度下,该反应达到平衡状态后,增加N2的浓度,化学反应平衡常数变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com