
【题目】SO2通入下列溶液中,溶液褪色或变浅,说明SO2具有漂白作用的组合是( )
①KMnO4(H+ , aq) ②溴水 ③碘水 ④氯水 ⑤Fe3+(aq)
A.①⑤
B.②③
C.全部
D.都不是
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是

A. 该电池不适宜在过高或过低温度下使用
B. 正极反应中有CO2生成
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2==6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.1mol/L的NaClO溶液中滴加稀硫酸,HClO和ClO-所占分数(α)随pH变化的关系如图所示。下列表述不正确的是
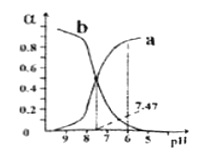
A. 曲线b代表ClO-
B. HClO的电离平衡常数Ka=10-7.47
C. pH=7时,c(Na+)>c(HClO)>c(ClO-)
D. 向pH=6的该溶液中加入少量的Na2SO3固体,c(ClO-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,在指定条件下能大量共存的离子组是
A. 无色透明溶液中:Na+ 、Cu2+ 、Cl- 、S2
B. 遇酚酞试剂变红的溶液:Fe3+ 、K+ 、SO42 、NO![]()
C. 含有大量 CO32-的溶液:K+ 、 Ba2+ 、OH- 、SO42
D. 含有大量 H+ 的溶液:Mg2+ 、NH4+ 、NO3- 、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图中四个图像的说法正确的是
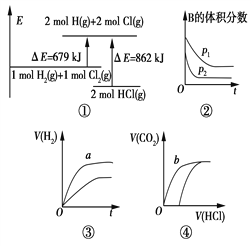
注:图中,E表示能量,p表示压强,t表示时间,y表示体积。
A. ①表示化学反应H2(g)+Cl2(g)===2HCl(g)的能量变化,则该反应的反应热ΔH=183 kJ/mol
B. ②表示其他条件不变时,反应4A(g)+3B(g) ![]() 2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是非气体。
2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是非气体。
C. ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示HCl溶液。
D. ④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH1=+234.1 kJ·mol-1①
C(s)+O2(g=CO2(g) ΔH2=-393.5 kJ·mol-1②
则Fe和O2反应生成Fe2O3的热化学反应方程式为_______________________________。
(2)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
①常温下NaHA溶液的pH________(填序号),原因是____________________________。
A.大于7 B.小于7 C.等于7 D.无法确定
②已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有______________________。
Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有______________________。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
(3)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.65 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.93 | 20.00 |
请完成下列填空:
①滴定达到终点的标志是_____________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为_____________________(保留两位有效数字)。
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________(填字母序号)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:Pb (s)+ PbO2(s) +2H2SO4(aq)![]() 2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是
2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是
A. PbO2是电池的负极 B. 铅蓄电池属于一次电池
C. 负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) D. 电池放电时,溶液酸性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com