
【题目】汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:Pb (s)+ PbO2(s) +2H2SO4(aq)![]() 2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是
2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是
A. PbO2是电池的负极 B. 铅蓄电池属于一次电池
C. 负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) D. 电池放电时,溶液酸性增强
科目:高中化学 来源: 题型:
【题目】SO2通入下列溶液中,溶液褪色或变浅,说明SO2具有漂白作用的组合是( )
①KMnO4(H+ , aq) ②溴水 ③碘水 ④氯水 ⑤Fe3+(aq)
A.①⑤
B.②③
C.全部
D.都不是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=1.该温度下在体积均为1L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5min时的浓度如表所示.下列判断不正确的是( )
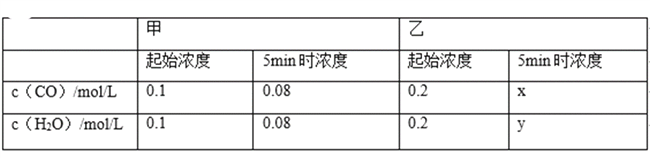
A. x=y=0.16
B. 反应开始时,乙中反应速率比甲快
C. 甲中0~5min的平均反应速率:v(CO)=0.004 mol/(Lmin)
D. 平衡时,乙中H2O的转化率是50%,c(CO)是甲中的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol .L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
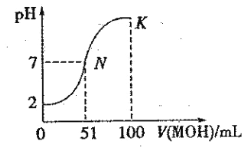
(1)由图中信息可知HA为 酸(填“强”或“弱”),理由是 _。
(2)常温下一定浓度的MA稀溶液的pH = a,则a 7(填“ > ”、“,< ”或“=”),用离子方程式表示其原因: ____________,此时,溶液中由水电离出的c(OH-)= 。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_________。
(4)K 点对应的溶液中,c(M+) +c(MOH) 2c (A-)(填“>”“<”或“=”);若此时溶液的 pH = 10,则 c(MOH) +c(OH-) = mol· L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 钠和冷水反应:Na+2H2O=Na++2OH+H2↑
B. 澄清石灰水与少量NaHCO3溶液混合:Ca2+ + OH-+ HCO3-![]() CaCO3↓+ H2O
CaCO3↓+ H2O
C. 向沸水中滴入适量的饱和氯化铁溶液;Fe 3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D. 碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+ OH-=CO32-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘油具有吸水保湿性能。工业上由丙烯制备甘油的流程之一如下:
![]()
下列说法中正确的是
A. ①②③均为取代反应
B. CH2ClCHClCH2Cl的同分异构体有5种(不含立体异构)
C. 流程中4种有机物均可使溴的CCl4溶液褪色
D. CH2=CHCH2Cl、CH3CH=CH2分子均至少有6个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol CH4的质量为________g,约含有______个H,在标准状况下的体积为_______L。
(2)相同质量的CO和CO2,它们所含的原子数之比为_______,在同温同压下,它们的密度之比为______;等物质的量的CO和CO2的混合气体的密度是相同条件下氢气密度的__________倍。
(3)12.4 g Na2R含Na+0.4 mol,则R的相对原子质量为_____________。
(4)已知16 g肼(N2H4)含有的电子数为b,则阿伏加德罗常数为______________。(用含b的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 g碳与适量水蒸气反应生成CO和H2,需吸收10.94 kJ热量,此反应的热化学方程式为( )
A. C+H2O===CO+H2 ΔH=+131.3 kJ·mol-1
B. C(s)+H2O(g)===CO(g)+H2(g) ΔH=+10.94 kJ·mol-1
C. C(s)+H2O(l)===CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
D. C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用电解装置,探究“铁作阳极”时发生反应的多样性,实验过程如下。
I.KCl作电解质
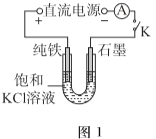
(1)一定电压下,按图-1装置电解,现象如下:
石墨电极上迅速产生无色气体,铁电极上无气体生成,铁逐渐溶解。
5min后U型管下部出现灰绿色固体,之后铁电极附近也出现灰绿色固体,10min后断开K。按图-2进行实验。
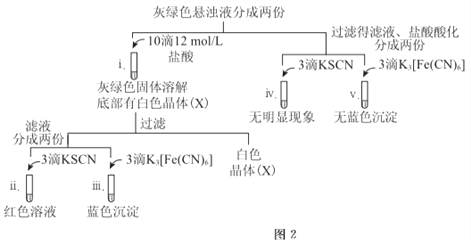
①石墨电极上的电极反应式是________。
②确认灰绿色固体中含有Fe2+的实验现象是_______。
③灼烧晶体X,透过蓝色钴玻璃观察到火焰呈紫色。结合平衡移动原理,解释“试管i中析出白色晶体”的原因是_______。
(2)其他条件不变时,用图-3装置重复实验,10min后铁电极附近溶液依然澄清,断开K。按图-4进行实验
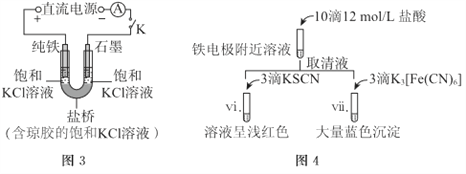
①盐桥的作用是_______。
②与实验I中vi、vii与ii~v中的现象比较,可以得出的结论是(答两点):_______。
II.KOH作电解质
(3)用图-1装置电解浓KOH溶液,观察到铁电极上立即有气体生成,附近溶液逐渐变为淡紫色(![]() ),没有沉淀产生。
),没有沉淀产生。
①铁电极上OH-能够放电的原因是______。
②阳极生成![]() 的总电极反应式是______。
的总电极反应式是______。
③某同学推测生成![]() 的必要条件是浓碱环境,将图-5中的实验方案补充完整,证实推测成立。
的必要条件是浓碱环境,将图-5中的实验方案补充完整,证实推测成立。
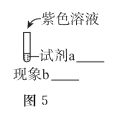 ______
______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com