
| A、放热反应一定不需要加热 |
| B、强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| C、使用催化剂不但能加快反应速率,而且可以让不可能发生的反应发生 |
| D、难溶物也可能是强电解质 |


科目:高中化学 来源: 题型:
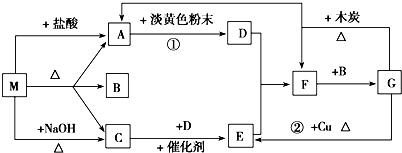
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有机玻璃(制不粘锅) |
| B、SiO2(制光纤) |
| C、钢化玻璃(火车窗玻璃) |
| D、氮化硅陶瓷(制导热剂) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=12的溶液:K+、Na+、CH3COO-、CO32- |
| B、0.1 mol/L的NaNO3溶液:H+、Fe2+、Cl-、SO42- |
| C、与铝反应产生大量氢气的溶液:Mg2+、K+、HCO3-、NO3- |
| D、由水电离产生的c(H+)=10-13mol/L的溶液:NH4+、Ca2+、SO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液中滴入石蕊呈红色,证明醋酸是弱电解质 |
| B、液态HCl不导电,证明HCl是共价化合物 |
| C、饱和石灰水中加入少量CaO,恢复至室温,溶液的pH增大 |
| D、向Na2CO3溶液中加入少量NaOH固体,抑制CO32-水解,溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24LH2O的分子数为0.1NA |
| B、0.1mol Na2O2中含有的阴离子数目为0.2NA |
| C、4.4 g CO2气体中含有的原子总数为0.3NA |
| D、1 L 0.1 mol?L-1 Al2(SO4)3溶液中Al3+的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH=2的HCl与pH=12的NH3?H2O 等体积混合后溶液呈酸性 |
| B、常温下,用pH=2和pH=3的醋酸溶液中和含等量NaOH的溶液所消耗醋酸溶液体积分别为Va,Vb,则Vb<10Va |
| C、常温下,向体积为V1L的浓度均为0.1mol/L HCl、CH3COOH混合溶液中加入 V2L 0.2mol/L的NaOH溶液后,溶液呈中性,则V1>V2 |
| D、常温下,pH为2的硫酸与0.01mol/L的NaOH溶液等体积混合后,混合溶液显酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com