
| A. | ①②③④⑦ | B. | ③④⑤⑦⑩ | C. | ①③④⑤⑦⑨ | D. | ①③④⑦⑩ |
分析 化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成,据此分析判断.
解答 解:①胆矾晶体在空气中失水风化,发生反应生成了新的物质,属于化学变化;
②溶液导电属于氧化还原反应属于化学变化,金属导电是电子定向移动 属于物理变化;
③燃烧是物质发生了发光放热的剧烈的氧化还原反应,属于化学变化;
④煤的干馏 是隔绝空气加强热发生复杂的物理化学变化;
⑤白磷转变成红磷过程中物质结构发生了变化,属于化学变化;
⑥工业制氧气是分离空气,属于物理变化;
⑦久置氯水变成无色是氯气和水反应生成的次氯酸分解促进化学平衡正向进行,属于化学变化;
⑧分馏是利用物质沸点不同,可知温度分离混合物,属于物理变化;
⑨NO2气体冷却后颜色变浅,是因为二氧化氮转化为四氧化二氮,属于化学变化;
⑩氢氧化铁胶体加入硫酸钠有沉淀生成是胶体聚沉,属于物理变化;
综上所述一定属于化学变化的是①③④⑤⑦⑨,
故选C.
点评 本题难度中等,解答时要分析变化过程中是否有新物质生成,若没有新物质生成属于物理变化,若有新物质生成属于化学变化.


科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| B. | 水溶液中导电能力差的电解质一定是弱电解质 | |
| C. | 强电解质在稀的水溶液中全部以离子的形态存在 | |
| D. | 强电解质都是离子化合物,而弱电解质都是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )| A. | 放电时,负极发生:2AlCl4--e-=Al2Cl3-+Cl- | |
| B. | 充电时,泡沫石墨极与外电源的负极相连 | |
| C. | 放电时,电路中每流过3mol电子,正极减少27g | |
| D. | 充电时,阴极发生:4Al2Cl3-+3e-=Al+7AlCl4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验过程中使用四氯化碳时戴防尘口罩 | |
| B. | 实验过程中移取强酸、强碱溶液应带防酸碱手套 | |
| C. | 实验场所严禁携带食物;禁止用饮料瓶装化学药品,防止误食 | |
| D. | 称取粉末状的有毒药品时,要带口罩防止吸入 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙、丙、丁四种元素均为短周期元素 | |
| B. | 元素丁形成的化合物比元素乙形成的化合物少 | |
| C. | 气态氢化物的稳定性比较:甲>乙 | |
| D. | 最高价氧化物对应水化物的酸性比较:甲<丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
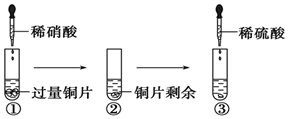 某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是
某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是| A. | ①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2 | |
| B. | ③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O | |
| C. | ③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强 | |
| D. | 由上述实验可知:Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
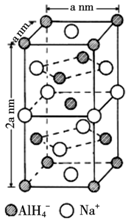
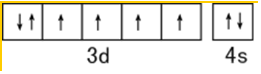 .
.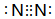 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+0.45Fe3+0.50O | B. | Fe2+0.85Fe 3+0.10O | ||
| C. | Fe2+0.15Fe3+0.80O | D. | Fe2+0.20Fe 3+0.75O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com