
分析 Ⅰ、水电离出OH-和H3O+离子,二者电子总数相等;
Ⅱ、(1)符合X+W→Y+V,已知X和Y分别是短周期同主族两种元素形成的单质,W、V是化合物,
①W是水,则该反应为有水参加的置换反应,生成的单质一定为H2,则X应为Na;
②V是水,则W为氢化物,且X为O2;
(2)常见由短周期元素组成的有色气体有Cl2、NO2,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂.
解答 解:Ⅰ、水电离出OH-和H3O+离子,二者电子总数相等,则电离方程式为H2O+H2O═OH-+H3O+,
故答案为:H2O+H2O═OH-+H3O+;
Ⅱ、(1)符合X+W→Y+V,已知X和Y分别是短周期同主族两种元素形成的单质,W、V是化合物,则
①W是水,且做还原剂,则X为F2,反应的方程式为2F2+2H2O═4HF+O2↑,
故答案为:2F2+2H2O═4HF+O2↑;
②V是水,则W为氢化物,且X为O2,符合条件的置换反应为O2+2H2S═2H2O+2S↓,
故答案为:O2+2H2S═2H2O+2S↓;
(2)常见由短周期元素组成的有色气体有Cl2、NO2,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,由于MA>MB,故A为氯气,B为NO2.
①Cl2与水反应生成HCl和HClO,化学方程式为Cl2+H2O═HCl+HClO,
故答案为:Cl2+H2O═HCl+HClO;
②NO2中存在平衡:2NO2?N2O4,故导致NO2气体不是纯净物.故答案为:2NO2?N2O4;
点评 本题考查离子共存、氧化还原反应以及无机物的推断等知识,题目较为综合,难度中等,本题注意常见元素化合物知识的积累,牢固把握基础知识,此类题目可较容易解答.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液中通入少量CO2:CO2+OH-═HCO3- | |
| B. | 碳酸氢铵溶液中加入足量热的氢氧化钠溶液:NH4++OH-NH3↑+H2O | |
| C. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑦ | B. | ③④⑤⑦⑩ | C. | ①③④⑤⑦⑨ | D. | ①③④⑦⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4所含的分子数为NA | |
| B. | 1mol的羟基(-OH)与1 mol的氢氧根(OH -)离子所含电子数均为9 NA | |
| C. | 常温常压下,在30g 的乙烷气体分子中,碳氢键的总个数为6NA | |
| D. | 一定条件下,将2molSO2与足量的O2充分反应,生成SO3的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
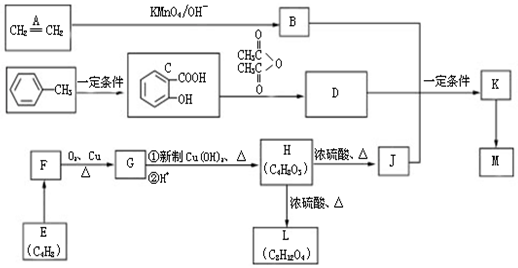

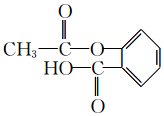 .
.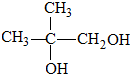 ,H→J的反应类型消去反应.
,H→J的反应类型消去反应. .
.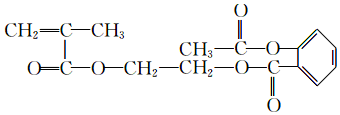 .
. .
. 或
或 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的电子式: | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | CO2的分子模型示意图: | D. | O2-的离子结构示意图: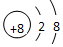 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫化亚铁中加入稀硫酸 2H++S2-→H2S↑ | |
| B. | 向苯酚钠溶液中通入少量的CO2 -O-+CO2+H2O→ -O-+CO2+H2O→ -OH+HCO3- -OH+HCO3- | |
| C. | 向碳酸氢钠溶液中滴入少量石灰水 HCO3-+Ca2++OH-→CaCO3↓+H2O | |
| D. | 向明矾溶液中加入过量的氨水 A13++3NH3•H2O→Al(OH)3↓+3NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com